题目内容
9.下列说法错误的是( )| A. | 实验室制取蒸馏水不需要温度计 | B. | 使用容量瓶前检查是否漏水 | ||
| C. | 用20mL量筒量取18.36mL水 | D. | 分液漏斗用于萃取和分液 |
分析 A.水中的杂质难挥发;
B.具有活塞或塞子的仪器使用前需要检查是否漏液;
C.量筒精确到0.1;
D.萃取、分液必须用到的仪器名称叫分液漏斗.
解答 解:A.水中的杂质难挥发,水易挥发,故A正确;
B.具有活塞或塞子的仪器使用前需要检查是否漏液,则使用容量瓶时,要首先检查是否漏水,故B正确;
C.量筒精确到0.1,无法量取18.36mL水,故C错误;
D.萃取、分液必须用到的仪器名称叫分液漏斗,分液时,下层液体从下口倒出,上层液体从上口倒出,故D正确.
故选C.
点评 本题考查化学实验的基本操作,题目难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.

练习册系列答案
相关题目
20.下列各组物质中,分子数相同的是( )
| A. | 2L SO2和2L CO2 | B. | 9g水和标准状况下11.2L CO2 | ||
| C. | 标准状况下1mol氧气和22.4L水 | D. | 0.2mol H2S和2.24L HCl |
17.草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol•L-1 NaHC2O4溶液中滴加0.01mol•L-1 NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
| A. | V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4-) | |
| B. | V(NaOH)<10 mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| C. | V(NaOH)=10 mL时,c(H+)=1×10-7 mol/L | |
| D. | V(NaOH)=0时,c(H+)=1×10-2 mol•L-1 |
14.遇到下列情况,处理不当的是( )
| A. | 不小心将少量浓硫酸沾到皮肤,立即用水冲洗 | |
| B. | 皮肤上沾有浓碱溶液时,立即用酒精冲洗 | |
| C. | 为了避免浪费,应该把实验用剩的药品放回原试剂瓶中 | |
| D. | 连接并组装成套仪器时,一般按自下而上、从左到右的顺序进行安装 |
1.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
(1)如图1是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;
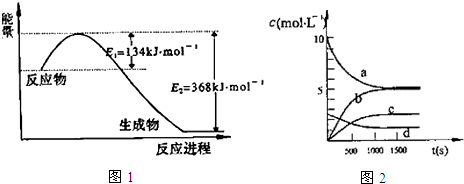
已知:N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H=-760.3kJ•mol-1;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如表:
①写出该反应的平衡常数表达式:K=$\frac{{c}^{2}({N}_{2}{O}_{5})}{{c}^{4}(N{O}_{2})×c({O}_{2})}$,
已知:K3000C>K3500C,则该反应是放热反应(填“放热”或“吸热”);
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有AD
A.降低温度 B.充入氦气,使体系压强增大 C.再充入NO2 D.再充入4mol NO2和1mol O2
③图2中表示N2O5的浓度的变化曲线是c,用O2表示从0~500s内该反应的平均速率v=0.00151 mol•L-1•s-1.
(1)如图1是1mol NO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:NO2(g)+CO(g)═CO2(g)+NO(g)△H=-234kJ•mol-1;

已知:N2(g)+2NO2(g)?4NO(g)△H=+292.3kJ•mol-1,
则反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)的△H=-760.3kJ•mol-1;
(2)一定温度下,在体积为2L的恒容密闭容器中充入20mol NO2和5mol O2发生反应:4NO2(g)+O2(g)?2N2O5(g);已知体系中n(NO2)随时间变化如表:
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
已知:K3000C>K3500C,则该反应是放热反应(填“放热”或“吸热”);
②反应达到平衡后,NO2的转化率为49.6%,若要增大NO2的转化率,可采取的措施有AD
A.降低温度 B.充入氦气,使体系压强增大 C.再充入NO2 D.再充入4mol NO2和1mol O2
③图2中表示N2O5的浓度的变化曲线是c,用O2表示从0~500s内该反应的平均速率v=0.00151 mol•L-1•s-1.
 .
.