题目内容
11.元素A、B、C、D、E、F原子序数依次增大,且都为短周期元素.A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与气体BA3化合生成离子化合物乙;D与A位于同一主族;E与C形成的化合物是大气污染物,容易形成酸雨;F元素最高化合价与最低化合价的代数和为6.(1)由A、C、F三种元素按原子个数比1:1:1组成的化合物的电子式为
 ,该化合物与BA3反应生成B的单质,写出该反应的化学反应方程式3HClO+2NH3=3HCl+N2+3H2O.
,该化合物与BA3反应生成B的单质,写出该反应的化学反应方程式3HClO+2NH3=3HCl+N2+3H2O.(2)将化合物EC2通入只含有 n mol 化合物D2E的溶液中,充分反应后,溶液出现浑浊,则该化合物D2E的溶液最多能吸收化合物EC2的物质的量为2.5n mol (不考虑水中溶解的化合物EC2)
(3)常温下,若甲、乙两溶液的pH均等于5,则由水电离出的$\frac{c({H}^{+})_{甲}}{c({H}^{+})_{乙}}$=10-4;乙溶液中所含离子的物质的量浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-).
(4)电解由A与F形成化合物的溶液时,若阴、阳极都用石墨作电极,则阴极发生还原反应(填“氧化”、“还原”),阳极的电极反应式为2Cl--2e-=Cl2↑.
分析 短周期元素A、B、C、D、E、F原子序数依次增大.B的最高价氧化物对应的水化物甲与气体BH3化合生成离子化合物乙,则B为氮元素、甲为硝酸、乙为硝酸铵、BH3为NH3;E与C形成的化合物是大气污染物,容易形成酸雨,E为硫元素、C为氧元素;F元素最高化合价与最低化合价的代数和为6,F处于ⅦA族,则F为Cl元素;A与C可形成A2C2和A2C两种化合物,A处于ⅠA族,D与A位于同一主族,D的原子序数大于氧元素,故A为H元素、D为Na元素、A2C2为H2O2、A2C为H2O,据此解答.
解答 解:短周期元素A、B、C、D、E、F原子序数依次增大.B的最高价氧化物对应的水化物甲与气体BH3化合生成离子化合物乙,则B为氮元素、甲为硝酸、乙为硝酸铵、BH3为NH3;E与C形成的化合物是大气污染物,容易形成酸雨,E为硫元素、C为氧元素;F元素最高化合价与最低化合价的代数和为6,F处于ⅦA族,则F为Cl元素;A与C可形成A2C2和A2C两种化合物,A处于ⅠA族,D与A位于同一主族,D的原子序数大于氧元素,故A为H元素、D为Na元素、A2C2为H2O2、A2C为H2O.
(1)由A、C、F三种元素按原子个数比1:1:1组成的化合物为HClO,电子式为 ,该化合物与NH3反应生成氮气,反应还生成HCl与水,该反应的化学反应方程式:3HClO+2NH3=3HCl+N2+3H2O,
,该化合物与NH3反应生成氮气,反应还生成HCl与水,该反应的化学反应方程式:3HClO+2NH3=3HCl+N2+3H2O,
故答案为: ;3HClO+2NH3=3HCl+N2+3H2O;
;3HClO+2NH3=3HCl+N2+3H2O;
(2)将化合物SO2通入只含有 n mol 化合物Na2S的溶液中,充分反应后,溶液出现浑浊,说明生成S,当生成NaHSO3时吸收SO2最多,发生反应:5SO2+2Na2S+2H2O=3S↓+4NaHSO3,故最多吸收SO2的物质的量为n mol×$\frac{5}{2}$=2.5 n mol,
故答案为:2.5n mol;
(3)常温下,硝酸溶液中水电离的氢离子等于溶液中氢氧根的浓度,即氢离子浓度为$\frac{1{0}^{-14}}{1{0}^{-5}}$mol/L=10-9mol/L,硝酸铵溶液中氢离子为水电离产生,浓度为10-5mol/L,则由水电离出的$\frac{c({H}^{+})_{甲}}{c({H}^{+})_{乙}}$=$\frac{1{0}^{-9}mol/L}{1{0}^{-5}mol/L}$=10-4;
硝酸铵溶液中,铵根离子水解,溶液呈酸性,故溶液中所含离子的物质的量浓度由大到小的顺序是c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:10-4;c(NO3-)>c(NH4+)>c(H+)>c(OH-);
(4)电解HCl的溶液时,若阴、阳极都用石墨作电极,则阴极发生还原反应,阳极发生氧化反应,阳极上是氯离子获得电子生成氯气,阳极的电极反应式为:2Cl--2e-=Cl2↑,
故答案为:还原;2Cl--2e-=Cl2↑.
点评 本题考查结构性质位置关系、常用化学用语、溶液pH的有关计算、离子浓度大小比较、电解原理等,题目较为综合,难度中等,推断元素是解题的关键,(2)为易错点、难点,关键是明确发生的反应.

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案| A. | CH3CH2OH与CH2=CHCH2OH | |
| B. | CH3OH与HO-CH2-CH2-OH | |
| C. | HO-CH2-CH2-OH与HO-CH2-CH2-CH2-OH | |
| D. |  与 与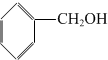 |
| A. | 金属单质可置换出非金属单质 | B. | 单质所属元素不一定是同主族元素 | ||
| C. | 单质可同为气态,也可同为固态 | D. | 均可在常温下进行反应 |
 常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示.下列叙述正确的是( )
常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如图所示.下列叙述正确的是( )| A. | 所用HCl的浓度是0.09mol•L─1,NaOH溶液浓度为0.03mol•L-1 | |
| B. | 在B点,溶液中离子浓度关系为:c(Na+)>c(Cl-)>c(H+)>c(OH-) | |
| C. | A.B.C三点水的电离程度大小依次为:A>B>C | |
| D. | 滴定前,锥形瓶用待测液润洗,导致HCl浓度偏低 |
| A. | 28 g由C2H4和C3H6组成的混合物中含有氢原子的数目为4 NA | |
| B. | l mol Fe(NO3)3与足量HI溶液反应时转移的电子数为3NA | |
| C. | 1 mol Na2O2固体中含离子总数为4NA | |
| D. | 在标准状况下,11.2L NO2所含电子数为11.5NA |
 ) 发生酯化反应的产物.
) 发生酯化反应的产物. 、
、 、
、 任意一种.
任意一种. ,R-ONa$→_{△}^{Cl-R′}$R-O-R′(R-、R′-表烃基)
,R-ONa$→_{△}^{Cl-R′}$R-O-R′(R-、R′-表烃基)
 .
. 将1.0mol CH4和2.0mol H2O(g)通入容积为10L的反应器,在 一定条件下发生反应I,测得在一定压强下CH4的转化率与温度的关系如图.假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为0.03mol•L-1•min-1.
将1.0mol CH4和2.0mol H2O(g)通入容积为10L的反应器,在 一定条件下发生反应I,测得在一定压强下CH4的转化率与温度的关系如图.假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为0.03mol•L-1•min-1.
 .
. (任写一种).
(任写一种). 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
 2SO3(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是
2SO3(g),其起始物质的量及SO2的平衡转化率如下表所示。下列判断中正确的是