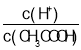题目内容
【题目】人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系![]() 即为:
即为:![]() 。下列判断正确的是( )
。下列判断正确的是( )
A.正常人血液内![]()
B.人体血液里碳酸氢盐缓冲体系主要是维持血液中![]() 和
和![]() 的平衡
的平衡
C.血液中![]() 的电离方程式为:
的电离方程式为:![]()
D.正常人血液中存在:![]()
【答案】C
【解析】
A.水的离子积与温度有关,人体正常体温为![]() ,不是常温下;
,不是常温下;
B.人体血液里碳酸氢盐缓冲体系主要是维持血液pH的稳定;
C.![]() 的电离以第一步为主;
的电离以第一步为主;
D.根据溶液中的电荷守恒分析。
![]() 常温下
常温下![]() ,而正常人的体温为
,而正常人的体温为![]() ,温度升高,水的离子积增大,则正常人血液内
,温度升高,水的离子积增大,则正常人血液内![]() ,故A错误;
,故A错误;
B.人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系![]() ,主要维持血液pH的相对稳定,不是维持血液中
,主要维持血液pH的相对稳定,不是维持血液中![]() 和
和![]() 的平衡,故B错误;
的平衡,故B错误;
C.![]() 的电离以第一步为主,
的电离以第一步为主,![]() 的电离方程式为:
的电离方程式为:![]() ,古C正确;
,古C正确;
D.根据电荷守恒可知,![]() ,故D错误。
,故D错误。
故选:C。

【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ |
② | 0 | 0 | 1 | 4 | 热量变化:QkJ |
下列说法中,不正确的是( )
A.容器①中反应达平衡时,CO的转化率为80%
B.容器①中CO的转化率等于容器②中CO2的转化率
C.平衡时,两容器中CO2的浓度相等
D.容器①时CO的反应速率等于H2O的反应速率
【题目】氨氧化法制硝酸的主要反应是:4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g)。
4NO(g) + 6H2O(g)。
(1)升高温度,反应的平衡常数K值减小,则该反应的焓变△H_____0(填“>”、“<”或“=”)。
(2)下列能说明上述反应已达到平衡状态__________(填序号)
A.NH3的浓度不随时间变化
B.v正(O2)= v逆(NO)
C.体系的分子总数不再变化
D.单位时间内消耗4molNH3的同时生成6molH2O
(3)若其他条件不变,下列关系图错误的是______(选填序号)。
A.  B.
B.  C.
C.  D.
D. 
(4)在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表:
时间/浓度/(mol·L-1) | c(NH3) | c(O2) | c(NO) | c(H2O) |
起始 | 4.0 | 5.5 | 0 | 0 |
第 2 min | 3.2 | 0.8 | 1.2 | |
第 4 min | 2.0 | 3.0 | 2.0 | 3.0 |
第 6 min | 2.0 | 3.0 | 2.0 | 3.0 |
①上表中空白处应填的数字为______。
②反应在第 2 min 到第 4 min 时,反应速率v(O2)=___________。
③反应在第 2 min 时改变了条件,改变的条件可能______;该条件下,反应的平衡常数K=_______(只写计算结果,不标单位)。