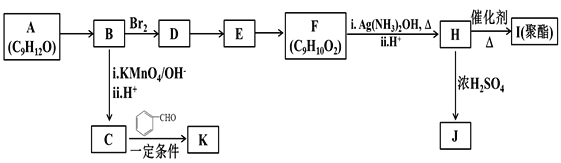
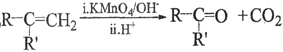��Ŀ����
����Ŀ��ij��ѧ��ȤС��Ϊ̽��Ԫ�����ʵĵݱ���ɣ����������ϵ��ʵ�顣
��1����NaOH��Һ��NH4Cl��Һ�������NH3��H2O ���Ӷ���֤NaOH�ļ��Դ���NH3��H2O�̶�������֤Na�Ľ����Դ���N������Ϊ������Ƿ��������˵�����ɣ� ��
��2����������ͼװ�ÿ�����֤�ǽ����Եı仯���ɡ������D����������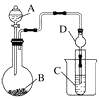
ʵ����������ҩƷNa2S��KMnO4��Ũ���ᡢMnO2 �� ��ѡ�����ҩƷ���ʵ����֤�ȵķǽ����Դ�������ƿ�з�����Ӧ�����ӷ���ʽΪ��
װ��C�е�ʵ������Ϊ�е���ɫ�������ɣ����ӷ���ʽΪ��
��3����Ҫ�ô�װ��֤�����ԣ�H2CO3��H2SiO3����֤���ǽ����ԣ�C��Si����A�м��۲쵽C����Һ������Ϊ��
���𰸡�
��1����������NH3��H2O����ΪN������������Ӧ��ˮ����
��2����������2MnO4-+10Cl-+16H��=2Mn2��+5Cl2+8H2O��Cl2+S2-=S��+2Cl-
��3��ϡH2SO4����H3PO4���ѻӷ��ᣩ��������ɫ��״����
����������1��Ԫ�صĽ�����Խǿ��������������ˮ�������Խǿ��һˮ�ϰ�����NԪ�ص�����������ˮ������Բ��ܱȽϽ�����ǿ����
��2��DΪ���õĸ���ܣ��л������ã������ܷ�ֹ������Ԫ�صķǽ�����Խǿ���䵥�ʵ�������Խǿ��ͬһ������ԭ��Ӧ���������������Դ�����������������ԣ���Ũ��������Ը��������Һ��ȡ�����������������Ƶõ�S���Ӷ�֤�����������Դ���S����ǽ�����Cl��S����ƿ�з�Ӧ�����ӷ���ʽΪ2MnO4-+10Cl-+16H��=2Mn2��+5Cl2��+8H2O����������ɫ���������ӷ���ʽΪCl2+S2-=S��+2Cl-��
��3��Ԫ�صķǽ�����Խǿ��������������ˮ��������Խǿ��ǿ���ܺ������η�Ӧ�������ᣬϡ�����̼���Ʒ�Ӧ���ɶ�����̼��������̼��������Һ��Ӧ���ɹ轺��������ɫ��״���ʣ���Ϊ������лӷ��ԣ��������ɵĶ�����̼�к���HCl��HClҲ�ܺ����Ʒ�Ӧ�������ϡ����������ᡣ

����Ŀ���±���Ԫ�����ڱ���һ���֣����ݱ��и����Ģ١�������Ԫ�أ��ش��������⣺
�� ���� | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� |
��1������Ԫ�آܵ�ԭ�ӽṹʾ��ͼ__________��
��2��Ԫ�آ��γɵ�����л���Ļ�ѧʽ��__________��
��3����������Ԫ���зǽ�������ǿ��Ԫ����__________����Ԫ�ط��ţ�
��4��Ԫ�آ��γɵ�����������Ӧ��ˮ����Ļ�ѧʽ��__________��
��5��Ԫ�آۺ�Ԫ�آ��γɵĻ�����ĵ���ʽ��__________��
��6����������Ԫ���н�������ǿ��Ԫ����__________����Ԫ�ط��ţ�
����Ŀ��ú��һ����Ҫ�Ļ���ԭ�ϣ����ǽ�����ú��ȡ��ˮú������̿�����ѵȹ㷺���ڹ�ũҵ�����С�
��1����֪����C(s)+H2O(g)�TCO(g)+H2(g) ��H=+131.3kJ��mol-1
��CO2(g)+H2(g)�TCO(g)+H2O(g) ��H=+41.3kJ��mol-1
��̼��ˮ������Ӧ���ɶ�����̼���������Ȼ�ѧ����ʽΪ���÷�Ӧ��(����¡��������¡����κ��¶ȡ�)�������������Է����С�
��2����������̿��ԭ�������������������ӦC(s)+2NO(g) ![]() N2(g)+CO2(g)����ij�ܱ������м���һ�����Ļ���̿��NO����T1��ʱ����ͬʱ���ø����ʵ�Ũ�����±���ʾ��
N2(g)+CO2(g)����ij�ܱ������м���һ�����Ļ���̿��NO����T1��ʱ����ͬʱ���ø����ʵ�Ũ�����±���ʾ��
ʱ��(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
��10��20min�ڣ�N2��ƽ����Ӧ����v(N2)=��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣬�����ϱ��е������жϸı����������������ĸ���)��
A��ͨ��һ������NO B������һ�����Ļ���̿
C��������ʵĴ��� D���ʵ���С���������
��3���о���������ӦCO(g)+H2O(g) ![]() H2(g)+CO2(g)ƽ�ⳣ�����¶ȵı仯���±���ʾ��
H2(g)+CO2(g)ƽ�ⳣ�����¶ȵı仯���±���ʾ��
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
����Ӧ��500��ʱ���У�����ʼʱCO��H2O��Ũ�Ⱦ�Ϊ0.020mol��L-1 �� �ڸ������´ﵽƽ��ʱ��CO��ת����Ϊ��