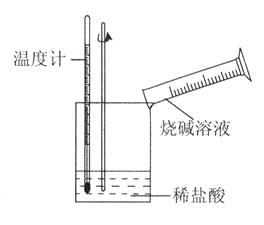
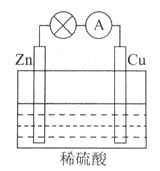
题目内容
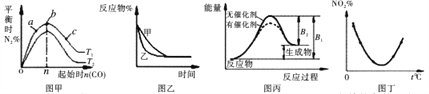
【题目】在体积为VL的恒容密闭容器中盛有一定量H2 , 通入Br2(g)发生反应:H2(g)+Br2(g) ![]() 2HBr(g) △H<0。当温度分别为T1、T2平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是( )
2HBr(g) △H<0。当温度分别为T1、T2平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是( )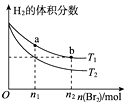
A.由图可知:T2>T1
B.a、b两点的反应速率:b>a
C.为了提高Br2(g)的转化率,可采取增加Br2(g)通入量的方法
D.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加
【答案】B
【解析】A.根据图象可知,当加入的n(Br2)均为n1建立化学平衡后,H2的体积分数温度T1的大于温度T2 , 该反应是正反应为放热反应,升高温度,平衡逆反应方向移动导致氢气的体积分数降低,所以T1>T2 , A不符合题意;
B.对a和b来说,温度相同,H2的初始量相同,Br2的初始量是b>a,a、b两个平衡状态,可以认为是向a的平衡状态加入(n2-n1)molBr2建立了化学平衡b,而加入Br2 , 平衡向正反应方向移动,建立平衡b后,其反应速率要增加,即两点的反应速率a<b,B符合题意;
C.增加Br2(g)通入量的方法,溴的转化率减小,C不符合题意;
D.当温度均为T1时,加入Br2 , 平衡会向正反应方向移动,导致HBr的物质的量不断增大,但体积分数不一定逐渐增大,这与加入的溴的量及转化率有关,D不符合题意,答案选B。
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).

【题目】下表是元素周期表的一部分,根据表中给出的①—⑥六种元素,回答下列问题:
族 周期 | I A | II A | III A | IV A | V A | VI A | VII A | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ |
(1)画出元素④的原子结构示意图__________;
(2)元素①形成的最简单有机物的化学式是__________;
(3)表中所列元素中非金属性最强的元素是__________(填元素符号)
(4)元素⑤形成的最高价氧化物对应的水化物的化学式是__________;
(5)元素③和元素⑥形成的化合物的电子式是__________。
(6)表中所列元素中金属性最强的元素是__________(填元素符号)