题目内容
【题目】乙醚是一种重要的医用麻醉剂,研究乙醇在催化剂A存在的条件下的脱水反应,对乙醚和酒精的工业生产都有重要意义,乙醇脱水涉及下列两个反应之间的竞争:
脱水制乙烯Ⅰ:C2H5OH(g)![]() C2H4(g)+H2O(g) △H1 K1
C2H4(g)+H2O(g) △H1 K1
脱水制乙醚Ⅱ:2C2H5OH(g)![]() C2H5OC2H5(g)+H2O(g) △H2 K2
C2H5OC2H5(g)+H2O(g) △H2 K2
研究所得相关信息如下:
①压强平衡常数与温度之间的关系

②不同温度下乙醇的转化率及选择性
反应温度(K) | 乙醇转化率(%) | 乙烯选择性(%) | 乙醚选择性(%) | 副产物选择性(%) |
373 | 25.22 | 4.38 | 94.52 | 1.10 |
423 | 54.25 | 52.24 | 46.71 | 1.05 |
523 | 95.20 | 96.87 | 2.15 | 0.98 |
根据上述信息回答下列问题:
(1)若反应:2C2H4(g)+H2O(g)![]() C2H5OC2H5(g)的焓变为△H3,平衡常数为K3,则△H3=_________(用含有△H1、△H2的式子表达);K3=____________(用含有K1、K2的式子表达)。
C2H5OC2H5(g)的焓变为△H3,平衡常数为K3,则△H3=_________(用含有△H1、△H2的式子表达);K3=____________(用含有K1、K2的式子表达)。
(2)△H1____0(填“>”、“ <”或“=”);乙醚的选择性是指用于生成乙醚的乙醇占反应消耗总乙醇量的百分比,表中数据表明:随着温度升高,乙醚选择性降低,简述理由:______________。
(3)除了改变温度外,请再提供一种提高乙醚产率的可行方法__________________________。
(4)为研究乙烯水合法合成乙醇,T℃时,可以认为只有反应Ⅰ,向体积为1L的密闭容器中投入0.6mol水和1mol乙烯,5min后恰好达到平衡。平衡后则得乙烯的转化率为5%,容器内的总压为7.75MPa,则
(5)向(4)中的容器中再加入0.6mol水和1mol乙烯,平衡后,乙烯的转化率___________(填“增大”、“ 减小”或“不变”)。
【答案】 ΔH2-2ΔH1 ![]() > 因为ΔH1>0,而ΔH2<0,升温推动Ⅰ平衡右移,而Ⅱ平衡左移,有利于乙烯的生成而不利于乙醚的生成,故乙醚的选择性降低 缩小体积增大压强、分离乙醚或者改用选择性更高的催化剂等等 0.01mol·L-1·min-1 52.25MPa 增大
> 因为ΔH1>0,而ΔH2<0,升温推动Ⅰ平衡右移,而Ⅱ平衡左移,有利于乙烯的生成而不利于乙醚的生成,故乙醚的选择性降低 缩小体积增大压强、分离乙醚或者改用选择性更高的催化剂等等 0.01mol·L-1·min-1 52.25MPa 增大
【解析】试题分析:(1)根据盖斯定律计算△H3;根据![]() 、
、![]() 、
、![]() 分析;(2) 根据压强平衡常数与温度之间的关系图,反应Ⅰ压强平衡常数随温度升高而增大;根据压强平衡常数与温度之间的关系,ΔH1>0,而ΔH2<0,升温推动Ⅰ平衡右移,而Ⅱ平衡左移;(3)反应Ⅱ正向移动可以提高乙醚产率;(4)利用“三段式”计算反应速率和压强平衡常数Kp;(5)根据等效平衡原理,向(4)中的容器中再加入0.6mol水和1mol乙烯,相当于加压;
分析;(2) 根据压强平衡常数与温度之间的关系图,反应Ⅰ压强平衡常数随温度升高而增大;根据压强平衡常数与温度之间的关系,ΔH1>0,而ΔH2<0,升温推动Ⅰ平衡右移,而Ⅱ平衡左移;(3)反应Ⅱ正向移动可以提高乙醚产率;(4)利用“三段式”计算反应速率和压强平衡常数Kp;(5)根据等效平衡原理,向(4)中的容器中再加入0.6mol水和1mol乙烯,相当于加压;
解析:(1) Ⅰ:C2H5OH(g)![]() C2H4(g)+H2O(g) △H1
C2H4(g)+H2O(g) △H1
Ⅱ:2C2H5OH(g)![]() C2H5OC2H5(g)+H2O(g) △H2
C2H5OC2H5(g)+H2O(g) △H2
根据盖斯定律Ⅱ—Ⅰ×2得 2C2H4(g)+H2O(g)![]() C2H5OC2H5(g) △H3=ΔH2-2ΔH1;
C2H5OC2H5(g) △H3=ΔH2-2ΔH1;![]() 、
、![]() 、
、![]() ,所以K3=
,所以K3=![]() ;(2)反应Ⅰ压强平衡常数随温度升高而增大,所以正反应吸热△H1>0;根据压强平衡常数与温度之间的关系,ΔH1>0,而ΔH2<0,升温推动Ⅰ平衡右移,而Ⅱ平衡左移,有利于乙烯的生成而不利于乙醚的生成,故乙醚的选择性降低;(3)反应Ⅱ正向移动可以提高乙醚产率,缩小体积增大压强、分离出乙醚都能使反应Ⅱ正向移动,所以提高乙醚产率的可行方法是缩小体积增大压强、分离出乙醚;
;(2)反应Ⅰ压强平衡常数随温度升高而增大,所以正反应吸热△H1>0;根据压强平衡常数与温度之间的关系,ΔH1>0,而ΔH2<0,升温推动Ⅰ平衡右移,而Ⅱ平衡左移,有利于乙烯的生成而不利于乙醚的生成,故乙醚的选择性降低;(3)反应Ⅱ正向移动可以提高乙醚产率,缩小体积增大压强、分离出乙醚都能使反应Ⅱ正向移动,所以提高乙醚产率的可行方法是缩小体积增大压强、分离出乙醚;
(4)
则5min内乙醇的的生成速率为![]() mol·L-1·min-1;Kp=
mol·L-1·min-1;Kp=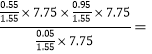 52.25MPa;(5)根据等效平衡原理,向(4)中的容器中再加入0.6mol水和1mol乙烯,相当于加压,增大压强,C2H5OH(g)
52.25MPa;(5)根据等效平衡原理,向(4)中的容器中再加入0.6mol水和1mol乙烯,相当于加压,增大压强,C2H5OH(g)![]() C2H4(g)+H2O(g)反应逆向移动,乙烯转化率增大。
C2H4(g)+H2O(g)反应逆向移动,乙烯转化率增大。

【题目】用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使电解液复原的组合是( )
X | Y | Z | W | |
A | C | Fe | NaCl | H2O |
B | Pt | Cu | CuSO4 | CuSO4溶液 |
C | C | C | H2SO4 | H2O |
D | Ag | Fe | AgNO3 | AgNO3晶体 |
A. A B. B C. C D. D




