题目内容
【题目】用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使电解液复原的组合是( )
X | Y | Z | W | |
A | C | Fe | NaCl | H2O |
B | Pt | Cu | CuSO4 | CuSO4溶液 |
C | C | C | H2SO4 | H2O |
D | Ag | Fe | AgNO3 | AgNO3晶体 |
A. A B. B C. C D. D
【答案】C
【解析】试题分析:A、该电解池中阳极氯离子放电产生氯气,阴极氢离子放电产生氢气,因此需要通入氯化氢,A错误;B、该电解池中阳极氢氧根放电产生氧气,阴极铜离子放电析出铜,需要加入氧化铜,B错误;C、惰性电极电解稀硫酸实质是电解水,因此加入水即可复原,C正确;D、银是阳极,铁是阴极,电解硝酸银溶液属于铁上镀银,不需要加入,D错误,答案选C。

 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案【题目】三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃。实验室可用如图装置制取ICl3。

(1)仪器a的名称是___________________。
(2)制备氯气选用的药品为漂白粉固体(主要成分为CaClO2)和浓盐酸,相关反应的化学方程式为_______________________________________。
(3)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象:____________________________。
(4)试剂X为____________________________。
(5)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为___________________。
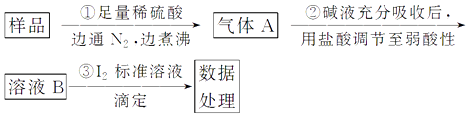
(6)欲测定上述实验制备ICl3样品中ICl3的纯度,准确称取ICl3样品10.0g于烧杯中,加入适量水和过量KI 晶体,充分反应生成I2(样品中杂质不反应)。写出反应的方程式_________________________;将所得溶液配置成100mL待测液,取25.00mL待测液,用2.0mol/L的Na2S2O3标准液滴定(I2+2S2O32- =2I-+ S4O62-),以淀粉溶液作指示剂,达到终点时的现象为______________________;重复滴定,实验数据记录如下:
滴定次数 | 待测液体积(mL) | Na2S2O3标准液体积/mL | |
滴定前读数(mL) | 滴定后读数(mL) | ||
1 | 25.00 | 0.50 | 20.40 |
2 | 25.00 | 4.00 | 24.10 |
3 | 25.00 | 4.20 | 26.70 |
该样品中ICl3的质量分数为____________________。(ICl3相对分子质量为233.5)
【题目】乙醚是一种重要的医用麻醉剂,研究乙醇在催化剂A存在的条件下的脱水反应,对乙醚和酒精的工业生产都有重要意义,乙醇脱水涉及下列两个反应之间的竞争:
脱水制乙烯Ⅰ:C2H5OH(g)![]() C2H4(g)+H2O(g) △H1 K1
C2H4(g)+H2O(g) △H1 K1
脱水制乙醚Ⅱ:2C2H5OH(g)![]() C2H5OC2H5(g)+H2O(g) △H2 K2
C2H5OC2H5(g)+H2O(g) △H2 K2
研究所得相关信息如下:
①压强平衡常数与温度之间的关系

②不同温度下乙醇的转化率及选择性
反应温度(K) | 乙醇转化率(%) | 乙烯选择性(%) | 乙醚选择性(%) | 副产物选择性(%) |
373 | 25.22 | 4.38 | 94.52 | 1.10 |
423 | 54.25 | 52.24 | 46.71 | 1.05 |
523 | 95.20 | 96.87 | 2.15 | 0.98 |
根据上述信息回答下列问题:
(1)若反应:2C2H4(g)+H2O(g)![]() C2H5OC2H5(g)的焓变为△H3,平衡常数为K3,则△H3=_________(用含有△H1、△H2的式子表达);K3=____________(用含有K1、K2的式子表达)。
C2H5OC2H5(g)的焓变为△H3,平衡常数为K3,则△H3=_________(用含有△H1、△H2的式子表达);K3=____________(用含有K1、K2的式子表达)。
(2)△H1____0(填“>”、“ <”或“=”);乙醚的选择性是指用于生成乙醚的乙醇占反应消耗总乙醇量的百分比,表中数据表明:随着温度升高,乙醚选择性降低,简述理由:______________。
(3)除了改变温度外,请再提供一种提高乙醚产率的可行方法__________________________。
(4)为研究乙烯水合法合成乙醇,T℃时,可以认为只有反应Ⅰ,向体积为1L的密闭容器中投入0.6mol水和1mol乙烯,5min后恰好达到平衡。平衡后则得乙烯的转化率为5%,容器内的总压为7.75MPa,则
(5)向(4)中的容器中再加入0.6mol水和1mol乙烯,平衡后,乙烯的转化率___________(填“增大”、“ 减小”或“不变”)。