题目内容
【题目】下列有关化学用语表示正确的是( )
A.K+的结构示意图: ![]()
B.B、基态氮原子的电子排布图 ![]()
C.水的电子式: ![]()
D.D、基态铬原子(24Cr)的价电子排布式:3d44s2
【答案】B
【解析】解:A.K+的质子数为19,核外电子数为18,各层电子数分别为2、8、8,钾离子结构示意图为:  ,故A错误;
,故A错误;
B.N元素为7号元素,原子核外有7个电子,所以核外电子排布式为:1s22s22p3,电子排布图为: ![]() ,故B正确;
,故B正确;
C.水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为: ![]() ,故C错误;
,故C错误;
D.Cr为24号元素,原子核外电子数为24,其中3d能级达到半满,简化电子排布式为[Ar]3d54s1,价电子排布式为:3d54s1,故D错误;
故选B.

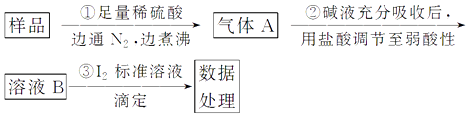
【题目】氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。
I.一氯胺(NH2Cl)在中性或酸性环境中会发生水解,生成具有强烈杀菌作用的HClO,是重要的水的消毒剂。
(1)写出NH2Cl的电子式______________。
(2)写出NH2Cl与水反应的化学方程式_____________________。
(3)一定条件下(T℃、latm),可以用Cl2(g)和NH3(g)制得NH2Cl(g) 同时得到HCl(g)。
已知部分化学键的键能如下表:
化学键 | N—H | Cl—Cl | N—Cl | H—Cl |
键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
写出该反应的热化学方程式________________________。
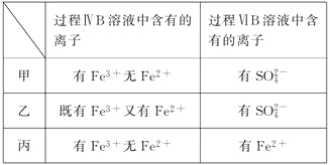
II.亚硝酸氯(NOCl)是有机合成中重要试剂,可由NO与Cl2在一定条件下合成。保持恒温恒容条件,将物质的量之和为3mol的NO 和Cl2以不同的氮氯比(![]() )进行反应2NO(g)+Cl2(g)
)进行反应2NO(g)+Cl2(g) ![]() 2NOCl(g) △H<0,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如图所示:
2NOCl(g) △H<0,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如图所示:

(4)图中T1、T2的关系为: T1____T2(填“>”、“<”或“=”)
(5)图中纵坐标为物质(填化学式)_________的转化率,理由为______________。
(6)图中A、B、C 三点中平衡时NOCl体积分数最大的是__________(填“A”、“ B” 或“C”)
(7)若容器容积为1L,则B点平衡常数为____________。
【题目】乙醚是一种重要的医用麻醉剂,研究乙醇在催化剂A存在的条件下的脱水反应,对乙醚和酒精的工业生产都有重要意义,乙醇脱水涉及下列两个反应之间的竞争:
脱水制乙烯Ⅰ:C2H5OH(g)![]() C2H4(g)+H2O(g) △H1 K1
C2H4(g)+H2O(g) △H1 K1
脱水制乙醚Ⅱ:2C2H5OH(g)![]() C2H5OC2H5(g)+H2O(g) △H2 K2
C2H5OC2H5(g)+H2O(g) △H2 K2
研究所得相关信息如下:
①压强平衡常数与温度之间的关系

②不同温度下乙醇的转化率及选择性
反应温度(K) | 乙醇转化率(%) | 乙烯选择性(%) | 乙醚选择性(%) | 副产物选择性(%) |
373 | 25.22 | 4.38 | 94.52 | 1.10 |
423 | 54.25 | 52.24 | 46.71 | 1.05 |
523 | 95.20 | 96.87 | 2.15 | 0.98 |
根据上述信息回答下列问题:
(1)若反应:2C2H4(g)+H2O(g)![]() C2H5OC2H5(g)的焓变为△H3,平衡常数为K3,则△H3=_________(用含有△H1、△H2的式子表达);K3=____________(用含有K1、K2的式子表达)。
C2H5OC2H5(g)的焓变为△H3,平衡常数为K3,则△H3=_________(用含有△H1、△H2的式子表达);K3=____________(用含有K1、K2的式子表达)。
(2)△H1____0(填“>”、“ <”或“=”);乙醚的选择性是指用于生成乙醚的乙醇占反应消耗总乙醇量的百分比,表中数据表明:随着温度升高,乙醚选择性降低,简述理由:______________。
(3)除了改变温度外,请再提供一种提高乙醚产率的可行方法__________________________。
(4)为研究乙烯水合法合成乙醇,T℃时,可以认为只有反应Ⅰ,向体积为1L的密闭容器中投入0.6mol水和1mol乙烯,5min后恰好达到平衡。平衡后则得乙烯的转化率为5%,容器内的总压为7.75MPa,则
(5)向(4)中的容器中再加入0.6mol水和1mol乙烯,平衡后,乙烯的转化率___________(填“增大”、“ 减小”或“不变”)。