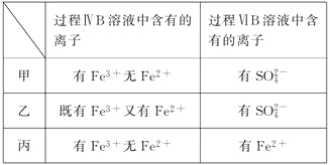
题目内容
【题目】如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( ) 
A.W元素的第一电离能小于Y元素的第一电离能
B.Y、Z的阴离子电子层结构都与R原子的相同
C.p能级未成对电子最多的是Z元素
D.X元素是电负性最大的元素
【答案】D
【解析】解:图为元素周期表前四周期的一部分,由位置可知,X为F,W为P,Y为S,Z为Br,R为Ar,
A.W的3p电子半满为稳定结构,则W元素的第一电离能大于Y元素的第一电离能,故A错误;
B.Y的阴离子有3个电子层,而Z的阴离子有4个电子层,则Y的阴离子电子层结构与R原子的相同,故B错误;
C.p能级未成对电子最多为3个,只有W符合,故C错误;
D.上述元素中F的非金属性最强,则X元素是电负性最大,故D正确;
故选D.
图为元素周期表前四周期的一部分,由位置可知,X为F,W为P,Y为S,Z为Br,R为Ar,
A.W的3p电子半满为稳定结构;
B.Y的阴离子有3个电子层,而Z的阴离子有4个电子层;
C.p能级未成对电子最多为3个,只有W符合;
D.上述元素中F的非金属性最强.

【题目】三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃。实验室可用如图装置制取ICl3。

(1)仪器a的名称是___________________。
(2)制备氯气选用的药品为漂白粉固体(主要成分为CaClO2)和浓盐酸,相关反应的化学方程式为_______________________________________。
(3)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象:____________________________。
(4)试剂X为____________________________。
(5)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为___________________。
(6)欲测定上述实验制备ICl3样品中ICl3的纯度,准确称取ICl3样品10.0g于烧杯中,加入适量水和过量KI 晶体,充分反应生成I2(样品中杂质不反应)。写出反应的方程式_________________________;将所得溶液配置成100mL待测液,取25.00mL待测液,用2.0mol/L的Na2S2O3标准液滴定(I2+2S2O32- =2I-+ S4O62-),以淀粉溶液作指示剂,达到终点时的现象为______________________;重复滴定,实验数据记录如下:
滴定次数 | 待测液体积(mL) | Na2S2O3标准液体积/mL | |
滴定前读数(mL) | 滴定后读数(mL) | ||
1 | 25.00 | 0.50 | 20.40 |
2 | 25.00 | 4.00 | 24.10 |
3 | 25.00 | 4.20 | 26.70 |
该样品中ICl3的质量分数为____________________。(ICl3相对分子质量为233.5)
【题目】氮的化合物在工业生产和生活中都有重要的应用,运用化学原理研究氮的单质及其化合物具有重要意义。
I.一氯胺(NH2Cl)在中性或酸性环境中会发生水解,生成具有强烈杀菌作用的HClO,是重要的水的消毒剂。
(1)写出NH2Cl的电子式______________。
(2)写出NH2Cl与水反应的化学方程式_____________________。
(3)一定条件下(T℃、latm),可以用Cl2(g)和NH3(g)制得NH2Cl(g) 同时得到HCl(g)。
已知部分化学键的键能如下表:
化学键 | N—H | Cl—Cl | N—Cl | H—Cl |
键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
写出该反应的热化学方程式________________________。
II.亚硝酸氯(NOCl)是有机合成中重要试剂,可由NO与Cl2在一定条件下合成。保持恒温恒容条件,将物质的量之和为3mol的NO 和Cl2以不同的氮氯比(![]() )进行反应2NO(g)+Cl2(g)
)进行反应2NO(g)+Cl2(g) ![]() 2NOCl(g) △H<0,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如图所示:
2NOCl(g) △H<0,平衡时某反应物的转化率与氮氯比及不同温度的关系结果如图所示:

(4)图中T1、T2的关系为: T1____T2(填“>”、“<”或“=”)
(5)图中纵坐标为物质(填化学式)_________的转化率,理由为______________。
(6)图中A、B、C 三点中平衡时NOCl体积分数最大的是__________(填“A”、“ B” 或“C”)
(7)若容器容积为1L,则B点平衡常数为____________。
【题目】乙醚是一种重要的医用麻醉剂,研究乙醇在催化剂A存在的条件下的脱水反应,对乙醚和酒精的工业生产都有重要意义,乙醇脱水涉及下列两个反应之间的竞争:
脱水制乙烯Ⅰ:C2H5OH(g)![]() C2H4(g)+H2O(g) △H1 K1
C2H4(g)+H2O(g) △H1 K1
脱水制乙醚Ⅱ:2C2H5OH(g)![]() C2H5OC2H5(g)+H2O(g) △H2 K2
C2H5OC2H5(g)+H2O(g) △H2 K2
研究所得相关信息如下:
①压强平衡常数与温度之间的关系

②不同温度下乙醇的转化率及选择性
反应温度(K) | 乙醇转化率(%) | 乙烯选择性(%) | 乙醚选择性(%) | 副产物选择性(%) |
373 | 25.22 | 4.38 | 94.52 | 1.10 |
423 | 54.25 | 52.24 | 46.71 | 1.05 |
523 | 95.20 | 96.87 | 2.15 | 0.98 |
根据上述信息回答下列问题:
(1)若反应:2C2H4(g)+H2O(g)![]() C2H5OC2H5(g)的焓变为△H3,平衡常数为K3,则△H3=_________(用含有△H1、△H2的式子表达);K3=____________(用含有K1、K2的式子表达)。
C2H5OC2H5(g)的焓变为△H3,平衡常数为K3,则△H3=_________(用含有△H1、△H2的式子表达);K3=____________(用含有K1、K2的式子表达)。
(2)△H1____0(填“>”、“ <”或“=”);乙醚的选择性是指用于生成乙醚的乙醇占反应消耗总乙醇量的百分比,表中数据表明:随着温度升高,乙醚选择性降低,简述理由:______________。
(3)除了改变温度外,请再提供一种提高乙醚产率的可行方法__________________________。
(4)为研究乙烯水合法合成乙醇,T℃时,可以认为只有反应Ⅰ,向体积为1L的密闭容器中投入0.6mol水和1mol乙烯,5min后恰好达到平衡。平衡后则得乙烯的转化率为5%,容器内的总压为7.75MPa,则
(5)向(4)中的容器中再加入0.6mol水和1mol乙烯,平衡后,乙烯的转化率___________(填“增大”、“ 减小”或“不变”)。