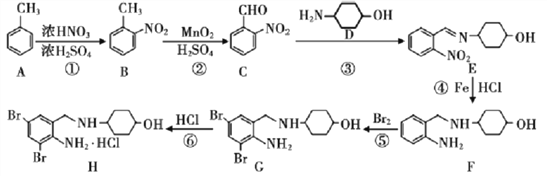
题目内容
【题目】工业制玻璃时,发生的主要反应的化学方程式为: ![]()
![]()
![]()
完成下列填空:
(1)钠原子核外具有______种不同能量的电子,钠元素在周期表中的位置为____________。
(2)在上述反应中,反应物和生成物的晶体类型共有_____种,写出气体产物的电子式_______________。
(3)上述物质中的非金属元素原子半径由大到小顺序为___________(用元素符号表示),下列能判断它们的非金属性强弱的依据是:________(选填编号)。
a. 气态氢化物的熔沸点 b. 最高价氧化物对应水化物的酸性
c. 气态氢化物的热稳定性 d. 三种元素两两形成的化合物中电子对偏向
(4)常温下,相同物质的量浓度的![]() 和
和![]() 溶液中,
溶液中, ![]() _____
_____ ![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(5)向10mL一定浓度的![]() 溶液中逐滴加入0.1mol/L的稀盐酸,加入盐酸的体积与产生气体的体积有如图关系。由此可知原
溶液中逐滴加入0.1mol/L的稀盐酸,加入盐酸的体积与产生气体的体积有如图关系。由此可知原![]() 溶液的物质的量浓度为__________。在滴入盐酸的整个过程中,溶液中
溶液的物质的量浓度为__________。在滴入盐酸的整个过程中,溶液中![]() 的变化情况是______________。
的变化情况是______________。

【答案】 4 第三周期第IA族 3 ![]() Si>C>O cd < 0.04mol/L 先增大后减小,最终几乎为0
Si>C>O cd < 0.04mol/L 先增大后减小,最终几乎为0
【解析】(1)基态钠原子的电子排布式为1s22s22p63s1,故其核外具有4种不同能量的电子,钠元素在周期表中的位置为第三周期第IA族。
(2)在上述反应中, ![]()
![]()
![]() 分别可以形成离子晶体、原子晶体、离子晶体和分子晶体,故反应物和生成物的晶体类型共有3种,气体产物
分别可以形成离子晶体、原子晶体、离子晶体和分子晶体,故反应物和生成物的晶体类型共有3种,气体产物![]() 的电子式为
的电子式为![]() 。
。
(3)上述物质中的非金属元素原子半径由大到小顺序为Si>C>O。a. 气态氢化物的熔沸点由分子间作用力决定;b. 最高价氧化物对应水化物的酸性由元素的非金属性决定,但是氧元素没有最高价氧化物对应水化物,不能以此比较其与其他元素的非金属性强弱;c. 气态氢化物的热稳定性由元素的非金属性决定;d. 三种元素两两形成的化合物中电子对偏向于非金属性较强的一方。所以,能判断它们的非金属性强弱的依据是cd。
(4)常温下,相同物质的量浓度的![]() 和
和![]() 溶液中,
溶液中, ![]() 的水解程度较大,所以,
的水解程度较大,所以, ![]() <
< ![]() 。
。
(5)向10mL一定浓度的![]() 溶液中逐滴加入0.1mol/L的稀盐酸,两者先按物质的量之比为1:1反应生成碳酸氢钠溶液,然后碳酸氢钠与盐酸再按1:1反应生成二氧化碳。由加入盐酸的体积与产生气体的体积关系的图像可知,两个阶段都相当于两者按体积比10:4=5:2反应,故两者物质的量浓度之比为2:5,由此可知原
溶液中逐滴加入0.1mol/L的稀盐酸,两者先按物质的量之比为1:1反应生成碳酸氢钠溶液,然后碳酸氢钠与盐酸再按1:1反应生成二氧化碳。由加入盐酸的体积与产生气体的体积关系的图像可知,两个阶段都相当于两者按体积比10:4=5:2反应,故两者物质的量浓度之比为2:5,由此可知原![]() 溶液的物质的量浓度为0.04mol/L。在滴入盐酸的整个过程中,溶液中
溶液的物质的量浓度为0.04mol/L。在滴入盐酸的整个过程中,溶液中![]() 的变化情况是先增大后减小,最终几乎为0。
的变化情况是先增大后减小,最终几乎为0。

 阅读快车系列答案
阅读快车系列答案【题目】三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃。实验室可用如图装置制取ICl3。

(1)仪器a的名称是___________________。
(2)制备氯气选用的药品为漂白粉固体(主要成分为CaClO2)和浓盐酸,相关反应的化学方程式为_______________________________________。
(3)装置B可用于除杂,也是安全瓶,能监测实验进行时装置C中是否发生堵塞,请写出发生堵塞时B中的现象:____________________________。
(4)试剂X为____________________________。
(5)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为___________________。
(6)欲测定上述实验制备ICl3样品中ICl3的纯度,准确称取ICl3样品10.0g于烧杯中,加入适量水和过量KI 晶体,充分反应生成I2(样品中杂质不反应)。写出反应的方程式_________________________;将所得溶液配置成100mL待测液,取25.00mL待测液,用2.0mol/L的Na2S2O3标准液滴定(I2+2S2O32- =2I-+ S4O62-),以淀粉溶液作指示剂,达到终点时的现象为______________________;重复滴定,实验数据记录如下:
滴定次数 | 待测液体积(mL) | Na2S2O3标准液体积/mL | |
滴定前读数(mL) | 滴定后读数(mL) | ||
1 | 25.00 | 0.50 | 20.40 |
2 | 25.00 | 4.00 | 24.10 |
3 | 25.00 | 4.20 | 26.70 |
该样品中ICl3的质量分数为____________________。(ICl3相对分子质量为233.5)
【题目】乙醚是一种重要的医用麻醉剂,研究乙醇在催化剂A存在的条件下的脱水反应,对乙醚和酒精的工业生产都有重要意义,乙醇脱水涉及下列两个反应之间的竞争:
脱水制乙烯Ⅰ:C2H5OH(g)![]() C2H4(g)+H2O(g) △H1 K1
C2H4(g)+H2O(g) △H1 K1
脱水制乙醚Ⅱ:2C2H5OH(g)![]() C2H5OC2H5(g)+H2O(g) △H2 K2
C2H5OC2H5(g)+H2O(g) △H2 K2
研究所得相关信息如下:
①压强平衡常数与温度之间的关系

②不同温度下乙醇的转化率及选择性
反应温度(K) | 乙醇转化率(%) | 乙烯选择性(%) | 乙醚选择性(%) | 副产物选择性(%) |
373 | 25.22 | 4.38 | 94.52 | 1.10 |
423 | 54.25 | 52.24 | 46.71 | 1.05 |
523 | 95.20 | 96.87 | 2.15 | 0.98 |
根据上述信息回答下列问题:
(1)若反应:2C2H4(g)+H2O(g)![]() C2H5OC2H5(g)的焓变为△H3,平衡常数为K3,则△H3=_________(用含有△H1、△H2的式子表达);K3=____________(用含有K1、K2的式子表达)。
C2H5OC2H5(g)的焓变为△H3,平衡常数为K3,则△H3=_________(用含有△H1、△H2的式子表达);K3=____________(用含有K1、K2的式子表达)。
(2)△H1____0(填“>”、“ <”或“=”);乙醚的选择性是指用于生成乙醚的乙醇占反应消耗总乙醇量的百分比,表中数据表明:随着温度升高,乙醚选择性降低,简述理由:______________。
(3)除了改变温度外,请再提供一种提高乙醚产率的可行方法__________________________。
(4)为研究乙烯水合法合成乙醇,T℃时,可以认为只有反应Ⅰ,向体积为1L的密闭容器中投入0.6mol水和1mol乙烯,5min后恰好达到平衡。平衡后则得乙烯的转化率为5%,容器内的总压为7.75MPa,则
(5)向(4)中的容器中再加入0.6mol水和1mol乙烯,平衡后,乙烯的转化率___________(填“增大”、“ 减小”或“不变”)。
【题目】已知X、Y、Z、W、R是元素周期表中前四周期的常见元素,相关信息如表所述:
元素 | 相关信息 |
X | 地壳中含量最多的元素 |
Y | 元素的气态氢化物极易溶于水,水溶液遇酚酞变红 |
Z | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物是自来水生产过程中常用的消毒剂 |
W | 与Z同周期,第一电离能至第四电离能分别是:I1=578kJmol﹣1 , I2=1817kJmol﹣1 , I3=2745kJmol﹣1 , I4=11575kJmol﹣1 |
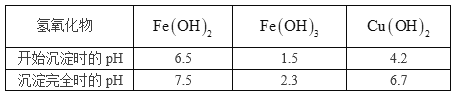
R | 有多种化合价,水溶液中其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(1)R在元素周期表中的位置为 , X的基态原子的价电子排布图为 , Z的基态原子的电子排布式为 .
(2)用“>”、“<”或“=”填空:
简单离子半径 | 第一电离能 | 电负性 | 气态氢化物稳定性 |
XY | XY | XZ | H2XYH3 |
(3)用方程式表示下列过程: ①Y的气态氢化物的水溶液遇酚酞变红的原因 ,
②W的最高价氧化物的水化物在水中发生电离 .