题目内容
13.(1)大气中SO2含量过高会导致雨水中含有(填化学式)H2SO4、H2SO3而危害植物和建筑物.工厂排放的SO2尾气用饱和Na2SO3溶液吸收可得到重要化工原料NaHSO3,反应的化学方程式为SO2+Na2SO3+H2O=2NaHSO3.(2)已知NaHSO3的水溶液显酸性,比较其中SO32-、HSO3-、H2SO3三种粒子的浓度:c(HSO3-)>c(SO32-)>c(H2SO3).
(3)SO2是空气质量报告的指标之一,可用SO2还原KIO3生成I2的反应测定空气中SO2含量.每生成0.01mol I2,参加反应的SO2为0.05mol.
(4)已知25℃时,Ksp(BaSO4)=1.1×10-10,Ksp (BaCO3)=2.6×10-9.下列说法不正确的是BC
A.25℃时,向BaSO4悬浊液中加入大量水,Ksp(BaSO4)不变
B.25℃时,向BaSO4悬浊液中加入Na2CO3溶液后,BaSO4不可能转化为BaCO3
C.向Na2SO4中加入过量BaCl2溶液后,溶液中c(SO42-)降低为零.
分析 (1)SO2导致硫酸型酸雨,N02导致HNO3型酸雨;
(2)根据NaHSO3的水溶液显酸性,知HSO3-的电离大于水解,可判断出离子浓度大小关系;
(3)根据得失电子数守恒SO2,即可得出每生成0.01mol I2,参加反应的SO2的量;
(4)A.Ksp只与温度有关,加水,Ksp不变;
B.当Qc=c(CO32-)•c(Ba2+)≥Ksp(BaCO3),就能转化为BaCO3;
C.向Na2SO4中加入过量BaCl2溶液后,Ksp(BaSO4)=1.1×10-10 不变,溶液中c(SO42-)不可能降低为零.
解答 解:(1)SO2能导致硫酸型酸雨,SO2溶于水:SO2+H2O═H2SO3,H2SO3能被部分氧化:H2SO3+O2=H2SO4,故大气中SO2含量过高会导致雨水中含有H2SO4和未被氧化完的H2SO3;
SO2用饱和Na2SO3溶液吸收可得NaHSO3,反应的化学方程式为:SO2+Na2SO3+H2O=2NaHSO3,
故答案为:H2SO4、H2SO3; SO2+Na2SO3+H2O=2NaHSO3;
(2)已知NaHSO3中的HSO3-既能电离又能水解:HSO3-?H++SO32-电离显酸性,HSO3-+H2O?H2SO3+OH- 水解显碱性;
NaHSO3的水溶液显酸性,说明电离大于水解,故:c(SO32-)>c(H2SO3),而HSO3-无论是电离还是水解程度都很小,故未电离和水解的HSO3-浓度远远大于电离和水解生成的SO32-和H2SO3浓度,故三种粒子的浓度:c(HSO3-)>c(SO32-)>c(H2SO3),
故答案为:c(HSO3-);c(SO32-);c(H2SO3);
(3)在此反应中,KIO3还原为I2,SO2被氧化为K2SO4.设当生成0.01mol I2时,需要得xmol电子,
由 2KIO3~得10e-~I2
2mol 10mol 1mol
xmol 0.01mol
则x=0.1mol,即生成0.01mol I2时,得0.1mol电子;
设当生成0.01mol I2时反应掉的SO2为ymol,由关系:SO2~失2e-~K2SO4
1mol 2mol
可知,ymolSO2失2ymol电子,
在氧化还原反应中,得失电子数相等,即有:2ymol═0.1mol,
解得y═0.05mol,即反应掉SO2为0.05mol,
故答案为:0.05;
(4)A.溶度积Ksp只受温度影响,温度不变,向BaSO4悬浊液中加入大量水,Ksp(BaSO4)不变,故A正确;
B.当c(CO32-)足够大时,能满足Qc=c(CO32-)•c(Ba2+)≥Ksp(BaCO3),BaSO4能转化为BaCO3,故B错误;
C.据Ksp(BaSO4)=c(SO42-)•c(Ba2+)═1.1×10-10 可知,c(Ba2+)越大,c(SO42-)越小,但不可能为零,故C错误;
故答案为:BC.
点评 本题考查了离子浓度的大小比较、酸雨的形成、沉淀之间的转化等知识,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力,注意明确酸雨成因、难溶物沉淀平衡及其计算,能够正确判断离子浓度大小.

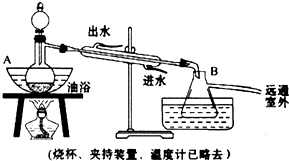
| A. | 蒸馏法 | B. | 水洗法 | C. | 分液法 | D. | 过滤法 |

| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加入冰醋酸 | |
| B. | 试管b中导气管下端管口不能侵入液面的目的是防止实验过程中产生倒吸现象 | |
| C. | 实验时加热试管a需小心均匀加热的原因是避免液体剧烈沸腾,减少乙醇,乙酸的挥发,防止温度过高时发生炭化 | |
| D. | 试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙酯 |
| A. |  存放浓硝酸 | B. |  向试管中滴加液体 | ||
| C. |  称量NaOH固体 | D. |  配制溶液时转移溶液 |
| A. | 金属钠 | B. | 溴水 | C. | 碳酸钠溶液 | D. | 新制Cu(OH)2悬浊液 |
 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )| A. | 正极反应式:Ca+2Cl--2e-═CaCl2 | |
| B. | 放电过程中,Li+向负极移动 | |
| C. | 每转移0.1 mol电子,理论上生成20.7 g Pb | |
| D. | 常温时,在正负极间接上电流表或检流计,指针不偏转 |
| A. | v(NH3)=0.25 mol•L-1•min-1 | B. | v(O2)=0.35mol•L-1•min-1 | ||
| C. | v(NO)=0.01 mol•L-1•s-1 | D. | v(H2O)=0.3 mol•L-1•min-1 |
 后静置,放出水层(废液).
后静置,放出水层(废液). ;该化合物的晶体类型离子晶体
;该化合物的晶体类型离子晶体