题目内容
17.已知在25℃、101kPa下,1g C8H18(l)燃烧生成CO2和液态H2O时放出48.40kJ的热量,表示上述反应的热化学方程式正确的是( )| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-48.40 kJ•mol-1 | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5 517.6 kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=+5 517.6 kJ•mol-1 | |
| D. | 2C8H18(l)+25O2(g)═16CO2(g)+18 H2O(l)△H=-5 517.6 kJ•mol-1 |
分析 1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,则1mol C8H18燃烧生成二氧化碳和液态水时放出热量为48.40kJ×114=5517.6kJ,以此来解答.
解答 解:由25℃,101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量,
则1molC8H18燃烧生成二氧化碳和液态水时放出热量为48.40kJ×114=5518kJ,
标明物质的聚集状态,该反应为放热反应,则
热化学反应方程式为C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5517.6kJ/mol,
即为:C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5517.6kJ•mol-1,
故选:B.
点评 本题考查热化学反应方程式的书写,明确物质的量与反应放出热量的关系及热方程式书写的方法即可解答,较简单.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
7.汽车尾气的转化反应之一为:2NO(g)+2CO(g)?N2(g)+2CO2(g),若反应在容积为0.5L的密闭容器中进行,由该反应相关图象作出的判断正确的是( )

| A. | 由图象甲可知,该反应正反应为放热反应 | |
| B. | 由图象乙可知,0~2s内平均速率V(CO)=1mol•L-1•s-1 | |
| C. | 由图象丙可知,t1时改变的条件可能为增大压强 | |
| D. | 由图象丁中,若X为c(CO),则纵坐标Y可能为NO的转化率 |
8.下列选用的相关仪器及基本操作符合实验要求的是( )
| A. |  存放浓硝酸 | B. |  向试管中滴加液体 | ||
| C. |  称量NaOH固体 | D. |  配制溶液时转移溶液 |
2.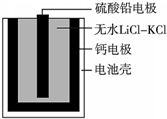 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
 热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
热激活电池可用作火箭、导弹的工作电源.一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池总反应为:PbSO4+2LiCl+Ca═CaCl2+Li2SO4+Pb.下列有关说法正确的是( )| A. | 正极反应式:Ca+2Cl--2e-═CaCl2 | |
| B. | 放电过程中,Li+向负极移动 | |
| C. | 每转移0.1 mol电子,理论上生成20.7 g Pb | |
| D. | 常温时,在正负极间接上电流表或检流计,指针不偏转 |
9.下列说法中正确的是( )
| A. | 40g SO3气体所占有的体积为11.2L | |
| B. | 1mol固体NaHCO3所含有的阴阳离子总数为3NA | |
| C. | 1mol/L的CH3COOH溶液中,CH3COO-总数小于NA | |
| D. | 常温常压下,32gO2和O3的混合气体含氧原子数为2NA |
6.食品香精菠萝酯的生产路线(反应条件略去)如下:

下列叙述错误的是( )

下列叙述错误的是( )
| A. | 步骤(1)产物中残留的苯酚可用FeCl3溶液检验 | |
| B. | 步骤(2)产物中残留的烯丙醇可用溴水检验 | |
| C. | 苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 | |
| D. | 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 |
7.如图所示Cu-Zn原电池,下列叙述正确的是( )


| A. | 锌为正极,发生氧化反应 | |
| B. | 铜为负极,铜片溶解 | |
| C. | 电子由铜片通过导线流向锌片 | |
| D. | 铜片上发生的电极反应:2 H++2e-=H2↑ |
 ;该化合物的晶体类型离子晶体
;该化合物的晶体类型离子晶体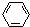 、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.
、④HCHO.其中碳原子采取sp2杂化的分子有①③④(填物质序号),HCHO分子的立体结构为平面三角形,它加成产物的熔、沸点比CH4的熔、沸点高,其主要原因是(须指明加成产物是何物质)加成产物CH3OH分子之间能形成氢键.