题目内容
5.乙二酸(HOOC-COOH)俗称草酸.某校学生为探究乙二酸的部分化学性质,进行了下述实验: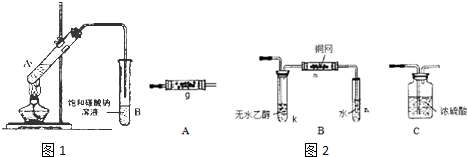
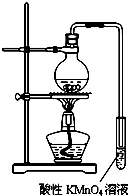
(1)向如图1的A试管中加入一定量的乙醇、浓硫酸和乙二酸,用酒精灯小火均匀加热试管 3~5min,在B试管中有油状液体产生,若反应中生成了分子中含有六个碳原子的化合物,该反应的化学方程式为:HOOCCOOH+2CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3CH2OOC-COOCH2CH3+2H2O;饱和碳酸钠溶液的作用是:除去酯中混有的乙二酸和乙醇,同时减小酯在水中的溶解度,便于分层析出;A 试管中的物质发生反应可能还会生成一种能使溴水褪色的有机化合物,请写出生成此化合物的化学方程式:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O
(2)已知:草酸分解的化学方程式为:H2C2O4 $\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO2↑+CO↑.某校同学设计了一套如图2所示的实验装置(夹持固定装置已略去,必要时可加热.),利用分解产物来完成以下性质探究实验.
将上述反应产生的混合气体按 C→A(内放置 CuO)→A(内放置 Na2O2)→B的顺序通入装置中,回答下列问题:
①需要加热的仪器装置有g、k、m(选填 g、k、m、n);
②A内放置CuO 的作用是除去混合气体中的CO
③B 中发生反应的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
分析 (1)乙醇和乙二酸在浓硫酸的作用下,发生酯化反应,若反应中生成了分子中含有六个碳原子的化合物,则在B试管中有油状液体为CH3CH2OOC-COOCH2CH3,其中有乙醇、乙二酸等杂质,用饱和碳酸钠溶液吸收主要目的是得到较纯的CH3CH2OOC-COOCH2CH3,在浓硫酸加热的条件下,乙醇可能产生乙烯,乙烯能使溴水褪色;
(2)将H2O、CO2、CO的混合气体通过浓硫酸,水份被吸收,得干燥的CO2、CO,CO2、CO混合气体再通过A(内放置 CuO)在加热条件下将CO氧化成CO2,再通过A(内放置 Na2O2)得O2,O2通入B与乙醇形成蒸气,在铜网作催化剂的条件下加热得乙醛,B装置中后面的试管中得乙醛溶液,据此答题;
解答 解:(1)乙醇和乙二酸在浓硫酸的作用下,发生酯化反应,若反应中生成了分子中含有六个碳原子的化合物,则在B试管中有油状液体为CH3CH2OOC-COOCH2CH3,反应的化学方程式为:HOOCCOOH+2CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3CH2OOC-COOCH2CH3+2H2O,油状液体中有乙醇、乙二酸等杂质,用饱和碳酸钠溶液吸收主要目的是除去酯中混有的乙二酸和乙醇,同时减小酯在水中的溶解度,便于分层析出,得到较纯的CH3CH2OOC-COOCH2CH3,在浓硫酸加热的条件下,乙醇可能产生乙烯,反应的化学方程式为CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,
故答案为:HOOCCOOH+2CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3CH2OOC-COOCH2CH3+2H2O;除去酯中混有的乙二酸和乙醇,同时减小酯在水中的溶解度,便于分层析出;CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;
(2)将H2O、CO2、CO的混合气体通过浓硫酸,水份被吸收,得干燥的CO2、CO,CO2、CO混合气体再通过A(内放置 CuO)在加热条件下将CO氧化成CO2,再通过A(内放置 Na2O2)得O2,O2通入B加热条件下与乙醇形成蒸气,在铜网作催化剂的条件下加热得乙醛,B装置中后面的试管中得乙醛溶液,
①根据上面的分析可知,需要加热的仪器装置有g、k、m,
故答案为:g、k、m;
②A内放置CuO 的作用是除去混合气体中的CO,
故答案为:除去混合气体中的CO;
③B中发生反应为乙醇的催化氧化,反应的化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
点评 本本题考查已二酸的分解以及溶液离子浓度的大小比较,题目较为综合且具有一定难度,做题时注意抓住反应的现象,以此推断物质可能具有的性质,题目难度中等.

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案| A. | 2LCO和2LCO2 | B. | 标准状况下22.4LH2O和1mol O2 | ||
| C. | 0,4克H2和4.48L HCl | D. | 18克水和标准状况下22.4L CO2 |
| A. | 削皮后的苹果应立即吃掉,不能在空气中放置太久 | |
| B. | 明矾溶于水最终可形成的Al(OH)3胶体,能吸附水中悬浮物以净化水 | |
| C. | 可用Na2CO3 治疗胃酸过多 | |
| D. | 不需要通过化学反应就能从海水中获得食盐和淡水 |
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
 .
.(2)元素Y的与氢元素形成一种离子YH4+,则检验溶液中存在该离子的方法是向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+离子,反之,不存在NH4+离子
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示);
下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态
(5)X、Y、Z三种元素中,有一种元素明显不同于其他两种元素是Al(用元素符号表示),理由Al是金属元素(或Al是第三周期元素).
| A. | 热稳定性:NH3<PH3<H2O | |
| B. | P元素最高价氧化物对应的水化物酸性比Cl的强 | |
| C. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | |
| D. | 元素非金属性:O>F |
| A. | 2mol/LAgNO3溶液 | B. | 2mol/LNaOH溶液 | C. | 2mol/LMgSO4溶液 | D. | Fe(OH)3胶体 |
| A. | N2的电子式: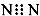 | B. | 钠离子的结构示意图: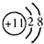 | ||
| C. | 乙烯的结构式:C2H4 | D. | CO2的比例模型: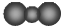 |
 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.
 .
.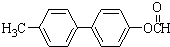 .
.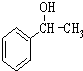 为原料制备
为原料制备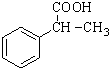 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.