题目内容
13.现有部分短周期元素的性质或原子结构如表:| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 第三周期元素的简单离子中半径最小 |
 .
.(2)元素Y的与氢元素形成一种离子YH4+,则检验溶液中存在该离子的方法是向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+离子,反之,不存在NH4+离子
(3)写出Z元素最高价氧化物对应的水化物与NaOH溶液反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O
(4)元素X与元素Y相比,非金属性较强的是N(用元素符号表示);
下列表述中能证明这一事实的是bc.
a.常温下X的单质和Y的单质状态不同
b.Y的最高价氧化物水化物的酸性比X的最高价氧化物水化物的酸性强
c.X与Y形成的化合物中X元素呈正价态
(5)X、Y、Z三种元素中,有一种元素明显不同于其他两种元素是Al(用元素符号表示),理由Al是金属元素(或Al是第三周期元素).
分析 X、Y、Z三种短周期元素,X元素原子最外电子数是次外层电子数的2倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素;Y元素常温下单质为双原子分子,其氢化物的水溶液呈碱性,则Y为氮元素;Z为第三周期元素的简单离子中半径最小,则Z为Al元素,据此解答.
解答 解:X、Y、Z三种短周期元素,X元素原子最外电子数是次外层电子数的2倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素;Y元素常温下单质为双原子分子,其氢化物的水溶液呈碱性,则Y为氮元素;Z为第三周期元素的简单离子中半径最小,则Z为Al元素,
(1)碳元素的一种同位素可测定文物年代,这种同位素的符号是614C,铝离子的结构示意图为 ,
,
故答案为:614C; ;
;
(2)元素Y的与氢元素形成一种离子YH4+为NH4+,检验溶液中存在NH4+离子的方法是向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+离子,反之,不存在NH4+离子,
故答案为:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+离子,反之,不存在NH4+离子;
(3)氢氧化铝与NaOH溶液反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(4)根据元素周期律可知,氮的非金属性强于碳,a.元素非金属性与状态无关,故不能证明氮的非金属性强于碳;
b.元素的非金属性越强,对应的最高价氧化物水化物的酸性越强,所以氮的最高价氧化物水化物的酸性比碳的最高价氧化物水化物的酸性强,能证明氮的非金属性强于碳;
c.碳与氮形成的化合物中碳元素呈正价态,说明氮原子得电子能力大于碳原子,所以能证明氮的非金属性强于碳,故选bc,
故答案为:N;bc;
(5)C、N、Al三种元素中,有一种元素明显不同于其他两种元素是Al,因为Al是金属元素(或Al是第三周期元素),
故答案为:Al;Al是金属元素(或Al是第三周期元素).
点评 本题考查结构性质位置关系、核外电子排布规律、元素周期律等,难度不大,推断元素是解题关键,注意基础知识的理解掌握.

| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(s,石墨)═C(s,金刚石)△H=+119 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 molNaOH的稀溶液混合,放出的热量大于57.3 kJ | |
| D. | 在25℃、101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量.则这些氢气完成燃烧生成气态水时,放出的热量比285.8 kJ还要多 |
| 实验方案 | 实验现象 |
| ①用砂纸擦后的镁带与沸水反应,再向反应液中滴加酚酞 | A.浮于水面,熔成小球,在水面上无定向移动,随之消失,溶液变成红色 |
| ②向新制的H 2S饱和溶液中滴加新制的氯水 | B.产生大量气体,可在空气中燃烧,溶液变成浅红色 |
| ③钠与滴有酚酞试液的冷水反应 | C.反应不十分剧烈,产生的气体可以在空气中燃烧 |
| ④镁带与2molL -1的盐酸反应 | D.剧烈反应,产生的气体可以在空气中燃烧 |
| ⑤铝条与2molL -1的盐酸反应 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向氯化铝溶液中滴加氢氧化钠溶液 | F.生成淡黄色沉淀 |
(1)实验目的:验证第三周期元素从左到右金属性递减、非金属性递增的规律.
(2)实验仪器:试管、酒精灯、镊子、小刀、玻璃片、胶头滴管等;
(3)实验内容:请将实验方案与实验现象一一对应(*填写题给信息表中的序号),写出化学方程式
| 实验方案* | 实验现象* | 有关化学方程式 |
(5)请用结构理论简单说明具有上述结论的原因.
(6)请你补充一组事实,说明此周期中另外两种元素的性质递变规律.
| A. | 短周期元素中,最外层电子数是其电子层数两倍的元素共有3种 | |
| B. | 第三周期元素的离子半径大小比较:S2->Cl->Na+>Mg2+>Al3+ | |
| C. | 日本核电站释放出的131I、132I和133I属于同素异形体 | |
| D. | 相同条件下,测定同浓度的Na2CO3溶液和Na2SO4溶液的pH,可比较C和S的非金属性强弱 |
 一定条件下2L的密闭容器中,反应aA(g)+bB(g)?cC(g)+dD(g)达到平衡.
一定条件下2L的密闭容器中,反应aA(g)+bB(g)?cC(g)+dD(g)达到平衡.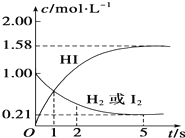 698K时,向某V L的密闭容器中充入2mol H2(g)和2mol I2(g),发生反应:H2(g)+I2(g)=2HI(g)△H=-26.5kJ•mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示.
698K时,向某V L的密闭容器中充入2mol H2(g)和2mol I2(g),发生反应:H2(g)+I2(g)=2HI(g)△H=-26.5kJ•mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示.
 .
.