题目内容
11.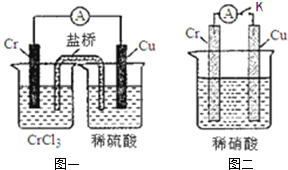 在如图装置中,观察到图一装置铜电极上产生大量的无色气泡.而在图二装置中当开关K断开时,铬电极无现象,K闭合时,铬电极上产生大量无色气体,并变成红棕色气体.
在如图装置中,观察到图一装置铜电极上产生大量的无色气泡.而在图二装置中当开关K断开时,铬电极无现象,K闭合时,铬电极上产生大量无色气体,并变成红棕色气体.根据上述现象,试推测金属铬的两个重要化学性质Cr比铜活泼、Cr会被稀HNO3钝化.
分析 由图1铜电极上产生大量的无色气泡,则铜为正极,铬为负极;由图2知,在稀硝酸中却出现了反常,结合稀硝酸的氧化性,不难推测铬被稀硝酸钝化,导致活性降低.
解答 解:由图1铜电极上产生大量的无色气泡,则铜为正极,铬为负极,所以金属铬的活动性比铜强;而图2中在稀硝酸中却出现了反常,铬电极上硝酸根离子得电子,则说明铬被稀硝酸氧化生成的氧化物阻止了铬进一步反应,即发生钝化现象,
故答案为:Cr比铜活泼;Cr会被稀HNO3钝化.
点评 本题综合考查原电池知识,侧重于学生的分析能力的考查,为高考常见题型和高频考点,注意把握原电池的工作原理,难度不大.

练习册系列答案
相关题目
1.在一定条件下,可逆反应2A(g)+B(g)?nC(s)+D(g)达平衡.若维持温度不变,增大压强,测得混合气体的平均相对分子质量不发生改变,则下列说法正确的是( )
| A. | 其它条件不变,增大压强,平衡不发生移动 | |
| B. | 该反应式中n值一定为2 | |
| C. | 其它条件不变,增大压强,混合气体的总质量不变 | |
| D. | 原混合气中A与B的物质的量之比为2:1,且2M(A)+M(B)=3M(D)(其中M表示物质的摩尔质量) |
2.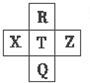 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2 剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2 剧烈化合并发生爆炸.则下列判断正确的是( )
 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2 剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2 剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 最高价氧化物对应的水化物的酸性:X<T<Q | |
| B. | 由于键能EH-R>EH-T,故元素R、T对应气态氢化物的沸点:HR>HT | |
| C. | R与Q的电子数相差16 | |
| D. | 元素R对应气态氢化物的相对分子质量实际测量值往往比理论上要大的多,这可能和氢键有关 |
6.如果定义有机物的同系列是一系列结构式符合A[W]nB(其中n=0,1,2,3…的化合物.式中A、B是任意一种基团(或氢原子),W为2价有机基团,又称为该同系列的系差,同系列化合物的性质往往呈现规律性变化.下列四组化合物中,不可称为同系列的是( )
| A. | CH3CH2CH2CH3、CH3CH2CH2CH2CH3、CH3CH2CH2CH2CH2CH3 | |
| B. | CH3CH=CHCHO、CH3CH=CHCH=CHCHO、CH3(CH=CH)3CHO | |
| C. | CH3CH2CH3、CH3CHClCH2CH3、CH3CHClCH2CHClCH3 | |
| D. | ClCH2CHClCCl3、ClCH2CHClCH2CHClCCl3、ClCH2CHClCH2CHClCH2CHClCCl3 |
16.下列表示对应化学反应的离子方程式.其中正确的是( )
| A. | 向NaAlO2溶液中通入足量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | (NH4)2Fe(SO4)2溶液中加入少量氢氧化钡溶液:NH4++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | 工业上用氨水吸收二氧化硫:2NH3.H2O+SO2═2NH4++SO32- | |
| D. | 磁性氧化铁溶于稀硝酸3Fe2++4H++NO3-═3Fe3++NO↑+2H2 |
3.下列说法正确的是( )
| A. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 | |
| B. | 用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率 | |
| C. | 制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸 | |
| D. | 实验室从海带提取单质碘的方法是:取样 灼烧 溶解 过滤 萃取 |
20.下列说法正确的是( )
| A. | HBr、KOH、CaCO3、H2O都是强电解质 | |
| B. | Na2O2、CaO、Al2O3都是碱性化合物,SiO2、SO2、NO2都是酸性氧化物 | |
| C. | 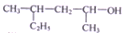 的名称为4-甲基-2-己醇 的名称为4-甲基-2-己醇 | |
| D. | ${\;}_{94}^{218}$Pu的质子数为94,中子数为238,电子数为144 |
1.化学与环境、生活、材料密切相关,下列说法正确的是( )
| A. | 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 | |
| B. | 二氧化氯和三氯化铁都常用于自来水的处理,二者的作用原理是相同的 | |
| C. | 通过有机合成,可以制造出比钢铁更强韧的新型材料 | |
| D. | 气溶胶和液溶胶的差别在于分散质的物质状态 |
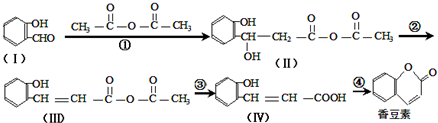
 .
. .
.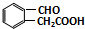 或
或 (任写一种).
(任写一种).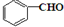 与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为
与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为 .
.