题目内容
2.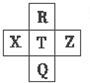 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2 剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2 剧烈化合并发生爆炸.则下列判断正确的是( )| A. | 最高价氧化物对应的水化物的酸性:X<T<Q | |
| B. | 由于键能EH-R>EH-T,故元素R、T对应气态氢化物的沸点:HR>HT | |
| C. | R与Q的电子数相差16 | |
| D. | 元素R对应气态氢化物的相对分子质量实际测量值往往比理论上要大的多,这可能和氢键有关 |
分析 R单质在暗处与H2剧烈化合并发生爆炸,R为F元素,由元素在周期表中的位置可知,T为Cl元素,Q为Br元素,X为S元素,Z为Ar元素,结合元素周期律解答.
解答 解:A、同主族自上而下,非金属性减弱,故非金属性Cl>Br,非金属性越强,最高价氧化物的水化物的酸性越强,故酸性:T>Q>X,故A错误;
B、HF含有氢键,作用力较强,沸点较高,与键能无关,故B错误;
C、R为F元素,Q为Br元素,原子序数相差26,故C错误;
D、R为F,对应的氢化物HF含有氢键,形成的气态氢化物含有多个“HF”,相对分子质量实际测量值往往比理论上要大的多,故D正确,故选D.
点评 本题主要考查结构位置性质关系、元素周期表的结构、元素周期律等,难度不大,推断R为氟元素是关键,注意掌握元素周期律.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.下述实验能达到预期实验目的是( )
| 序号 | 实验内容 | 实验目的 |
| A | 向盛有10滴0.1 mol•L-1AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol•L-1 Na2S溶液 | 证明AgCl能转化为溶解度更小的Ag2S |
| B | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 证明该溶液中一定含有大量的SO42- |
| C | 向某卤代烃中加入NaOH溶液,加热一段时间后,加入AgNO3溶液 | 检验卤代烃中的卤素原子 |
| D | 向纯碱中滴加足量盐酸,将产生的气体通入苯酚钠溶液 | 证明酸性:盐酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
17.已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 最高价氧化物对应水化物的碱性:C>D | |
| C. | 化合物AE与CE具有不同类型的化学键 | |
| D. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 |
14.下列图示实验操作正确的是( )
| A. | 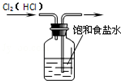 除去Cl2中的HCl | B. | 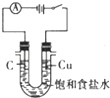 电解制Cl2和H2 | C. | 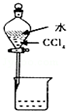 分离CCl4和水 | D. | 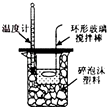 中和热的测定 |
12.在实验室里,下列除去杂质的方法正确的是 ( )
| A. | 溴苯中混有溴,加入KI溶液,用汽油萃取出溴 | |
| B. | 乙烷中混有乙烯,在一定条件下反应通入氢气,使乙烯转化为乙烷 | |
| C. | 硝基苯中混有浓硝酸和浓硫酸,将其倒入浓烧碱溶液中,静置,然后分液 | |
| D. | 乙烷中混有CO2,将其通入碳酸氢钠溶液洗气后干燥 |

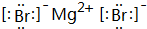


 ;
; ;
;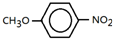 .
.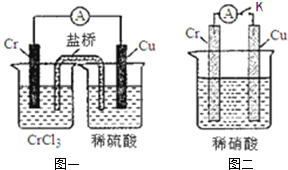 在如图装置中,观察到图一装置铜电极上产生大量的无色气泡.而在图二装置中当开关K断开时,铬电极无现象,K闭合时,铬电极上产生大量无色气体,并变成红棕色气体.
在如图装置中,观察到图一装置铜电极上产生大量的无色气泡.而在图二装置中当开关K断开时,铬电极无现象,K闭合时,铬电极上产生大量无色气体,并变成红棕色气体.