题目内容
16.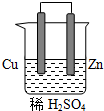 由铜、锌和稀硫酸组成的原电池中:
由铜、锌和稀硫酸组成的原电池中:锌是负极,电极反应式是Zn-2e-=Zn2+.
铜是正极,电极反应式是2H++2e-=H2↑.
在铜极上可以观察到有有气泡冒出(填实验现象)
分析 原电池形成条件是活泼性不同的两个电极,电解质溶液,闭合回路,自发进行的氧化还原反应,原电池中,得电子发生还原反应的电极是正极,失电子发生氧化反应的电极是正极,电子流向从负极盐导线流向正极,根据得失电子判断电极名称.
解答 解:由铜、锌和稀硫酸组成的原电池中,锌做负极失电子发生氧化反应,电极反应为Zn-2e-=Zn2+;铜做正极,溶液中氢离子得到电子生成氢气,发生还原反应,电极反应为2H++2e-=H2↑;铜极表面产生气泡;
故答案为:负,Zn-2e-=Zn2+;正,2H++2e-=H2↑,有气泡冒出.
点评 本题考查原电池的正负极的判断及电极反应式,注意根据氧化还原反应得失电子判断原电池的正负极,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列有关苯的性质描述中,正确的是( )
| A. | 苯能使酸性KMnO4溶液褪色 | |
| B. | 苯与稀硝酸、稀硫酸混合加热,生成硝基苯 | |
| C. | 苯与溴水混合振荡,静置,下层液体几乎为无色 | |
| D. | 1mol苯与2mol氢气发生加成反应生成1mol环己烷 |
11.下列有关说法正确的是( )
| A. | ${\;}_{92}^{235}$U原子核中含有92个中子 | |
| B. | ${\;}_{92}^{235}$U原子核外有143个电子 | |
| C. | ${\;}_{92}^{235}$U与${\;}_{92}^{238}$U互为同位素 | |
| D. | ${\;}_{92}^{235}$U原子与${\;}_{92}^{238}$U互为同素异形体 |
1.下列元素中,属于惰性气体元素的是( )
| A. | .钠 | B. | 氖 | C. | .铝 | D. | .硅 |
8.美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子的中子数为( )
| A. | 118 | B. | 175 | C. | 47 | D. | 293 |
5.分子式为C5H11Cl的同分异构体共有(不考虑立体异构)( )
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
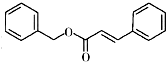 )俗称为肉桂酸苄酯,主要用在配制人造龙涎香,在东方型香精中作为定香剂,也用作皂用、化妆用及食用果实香精的调香原料.以下是我校化学兴趣小组设计的由芳香烃A为起始原料制备肉桂酸苄酯的合成路线:
)俗称为肉桂酸苄酯,主要用在配制人造龙涎香,在东方型香精中作为定香剂,也用作皂用、化妆用及食用果实香精的调香原料.以下是我校化学兴趣小组设计的由芳香烃A为起始原料制备肉桂酸苄酯的合成路线: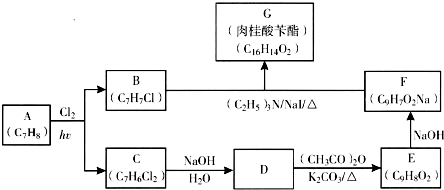
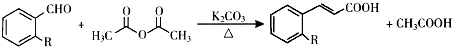
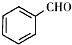 ;
;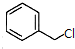 +
+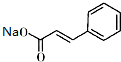 $\stackrel{(C_{2}H_{5})_{3}N/NaI/△}{→}$
$\stackrel{(C_{2}H_{5})_{3}N/NaI/△}{→}$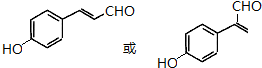 (写结构简式,若有多种可能,只写一种).
(写结构简式,若有多种可能,只写一种).