题目内容
4.短周期主要元素A、B、C、D、E、F、G的原子序数依次增大,已知A元素的某种原子不存在中子,B元素的最外层电子数是其内层电子数的2倍;D元素的某种单质是空气的主要成分之一,可与A形成A2D型化合物,E元素的原子是短周期所有元素中原子半径最大的元素,F的氧化物既能与强酸反应又能和强碱溶液反应,G元素可与A元素形成1:1的气态共价化合物AG,试回答下列问题:(1)写出B元素和D元素形成的化合物BD2的结构式O=C=O;
(2)下列关于化合物甲(B2A4)和乙(B6A6)的叙述中正确的是ac;
a.化合物甲在一定条件下可以与G的单质发生加成反应
b.化合物甲和乙都能够使酸性高锰酸钾溶液褪色
c.等质量的化合物甲和乙在足量的氧气中完全燃烧,前者消耗的氧气多
d.化合物乙和溴水可以发生取代反应
(3)试写出化合物B2A5DA在金属铜存在的条件下与D2反应的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(4)F的单质与A、D、E形成离子化合物反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(5)化合物BA3DA与D2的单质、氢氧化钾溶液可形成燃料电池,试写出负极反应的电极反应式CH3OH+8OH--6e-=CO32-+6H2O,正极附近溶液pH增大(填“增大”、“减小”或“不变”)
分析 短周期主要元素A、B、C、D、E、F、G的原子序数依次增大,A元素的某种原子不存在中子,则A为H元素;
B元素的最外层电子数是其内层电子数的2倍,最外层电子数不超过8个,所以B元素的K层为其内层,则最外层有4个电子,为C元素;
D元素的某种单质是空气的主要成分之一,可与A形成A2D型化合物,则D是O元素;
C元素原子序数大于B而小于D,所以C是N元素;
E元素的原子是短周期所有元素中原子半径最大的元素,则E是Na元素;
F的氧化物既能与强酸反应又能和强碱溶液反应,则F是Al元素;
G元素可与A元素形成1:1的气态共价化合物AG,且原子序数大于Al,所以G是Cl元素,再结合物质结构性质解答.
解答 解:短周期主要元素A、B、C、D、E、F、G的原子序数依次增大,A元素的某种原子不存在中子,则A为H元素;
B元素的最外层电子数是其内层电子数的2倍,最外层电子数不超过8个,所以B元素的K层为其内层,则最外层有4个电子,为C元素;
D元素的某种单质是空气的主要成分之一,可与A形成A2D型化合物,则D是O元素;
C元素原子序数大于B而小于D,所以C是N元素;
E元素的原子是短周期所有元素中原子半径最大的元素,则E是Na元素;
F的氧化物既能与强酸反应又能和强碱溶液反应,则F是Al元素;
G元素可与A元素形成1:1的气态共价化合物AG,且原子序数大于Al,所以G是Cl元素,
(1)B元素和D元素形成的化合物BD2为二氧化碳,二氧化碳分子中每个O原子和C原子形成两个共用电子对,其结构式为O=C=O,故答案为:O=C=O;
(2)化合物甲(C2H4)和乙(C6H6)分别是乙烯、苯,
a.乙烯和氯气在一定条件下能发生加成反应生成1,2-二氯乙烷,故正确;
b.乙烯能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,但苯和酸性高锰酸钾溶液不反应,故错误;
c.等质量烃完全燃烧,H元素的质量分数越大耗氧量越大,乙烯中H元素的质量分数比苯中H元素质量分数大,故等质量的苯和乙烯完全燃烧,乙烯耗氧量更多,故正确;
d.苯和溴水不反应,苯和液溴在溴化铁作催化剂条件下发生取代反应,故错误;
故选ac;
(3)化合物B2A5DA是乙醇,在金属铜存在的条件下与O2发生催化氧化反应,反应方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;
(4)F的单质是Al,A、D、E形成的离子化合物为NaOH,二者反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(5)甲醇、氧气碱性电池中,负极上甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O,正极上氧气得电子和水反应生成氢氧根离子,溶液pH增大,
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;增大.
点评 本题考查位置结构性质的相互关系及应用,涉及原电池原理、有机化学、物质结构等知识点,综合性较强,正确判断元素是解本题关键,难点是电极反应式的书写.

| A. | 乙酸和乙醇 | B. | 花生油和Na2CO3溶液 | ||
| C. | 酒精和水 | D. | 溴和苯 |
| A. | 用CO表示反应速率 | B. | 平衡混合气体的平均相对分子质量 | ||
| C. | CO的转化率 | D. | CO2的体积分数 |
| A. | 电解氯化铜溶液的阳极反应式为2Cl--2e-═Cl2↑ | |
| B. | 燃料电池负极加入或通入的物质是助燃物 | |
| C. | 原电池中电子从负极经过溶液流入正极 | |
| D. | 用惰性电极电解硝酸银溶液,一段时间后,溶液酸性增强 |
| A. | HCO3-、Na+、H+ | B. | Cu2+、HCO3-、OH- | C. | OH-、A13+、SO42- | D. | Mg2+、Ca2+、NO3- |
| A. | 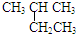 2-乙基丙烷 | B. | BrCH2CH2Br二溴乙烷 | ||
| C. |  间二甲苯 | D. | 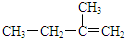 2-甲基-1-丁烯 |
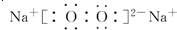 .
.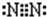 ,画出C元素的原子结构示意图
,画出C元素的原子结构示意图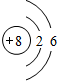 ;
; 由铜、锌和稀硫酸组成的原电池中:
由铜、锌和稀硫酸组成的原电池中: