��Ŀ����
����Ŀ��ij�о���ѧϰС��ͬѧ�����ij�п���������������ⶨ���п�����SO2�ĺ������ƶ������о�������
��.���ϱ�����SO2���н�ǿ�Ļ�ԭ�ԣ�����������������Һ������Ӧ��5SO2+2![]() +2H2O===5
+2H2O===5![]() +2Mn2++4H+��
+2Mn2++4H+��
��.���ʵ�鷽��������SO2�Ļ�ԭ��ʹSO2����֪Ũ�ȼ�����ĸ������������Һ��Ӧ��
��.ѡ������ص㣺ij��ҵ����ij����ij����С����ij��ҵ����ij��ͨ��Ŧ��
��.ѡ�����ʱ�䣺���졢���ٽ�Сʱ�����졢���ٽϴ�ʱ����ǰ�����
��.�Բⶨ�Ľ�����г�������������ص�λ������顣
��1����С��ͬѧ������ͼ��ʾװ�ö�������������SO2�ĺ�����
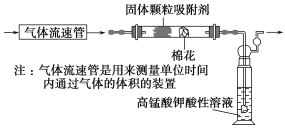
��ͨ�����ǰӦ���е�ʵ�������________________________________��
�ڵ��۲쵽ʵ�������Ϊ________________________________________ʱ��Ӧֹͣͨ������
��ʵ����������������¼��������_________________________________��
��2����ͼ��ʾ��С��ͬѧ����ʵ���õĸ��в�ͬ����������SO2�ĺ�����
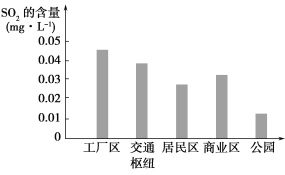
�ٹ���������ͨ��ŦSO2�������Ը�������������ԭ����_____________��
�������йز������һ�����ٹ�����SO2�ŷŵĽ��飺__________________________��
��3���±��Ǹ�С��ͬѧ��õIJ�ͬ��������µij��п�����SO2��ƽ�������������������ٽϴ�ʱSO2ƽ�������ϵ͵�ԭ��
������� | ƽ������(m��s1) | ������SO2��ƽ������(mg��L1) |
��ǰ | 2.0 | 0.03 |
��� | 2.2 | 0.01 |
�� | 23 | 0.015 |
�� | 0.9 | 0.03 |
��_____________________________________________________��
��_____________________________________________________��
���𰸡����װ�õ������� �������������Һ�պ���ɫ ͨ��������������������Һ�պ���ɫ����Ҫ��ʱ�� ����β��������β����SO2�����ϸ� ���������(����ø��ྻ����Դ�����β���Ĵ����������β�������ۺ����õȺ����𰸾���) ����ʱSO2��ˮ��Ӧ��������������SO2�ĺ��� ����Խ��������ɢ�ٶ�Խ������SO2Ũ��Խ
��������
��1����ʵ��ǰӦ���װ�õ������ԣ���ȷ��װ�ò�©�����Է�ֹӰ��ⶨ�����
��KMnO4����ǿ�����ԣ�����������л�ԭ�ԣ����߷�����Ӧ�����Կ�KMnO4��Һ�պ���ɫʱ��˵�����������ǡ��KMnO4��Һ��ȫ��Ӧ��Ӧֹͣͨ�������۶�����������ʵ������Ը���KMnO4�����ʵ�������������������������Ҫ֪����λʱ���ڿ��������ٺ�ʱ�������㣬������Ҫ֪������KMnO4��Һ�պ���ɫ����Ҫ��ʱ�䣻
��2������β���к��д�����SO2������β����SO2����Ҳ�ϸߣ����Թ���������ͨ��ŦSO2�������Ը���������������SO2��Դ�ڻ�ʯȼ�ϵ�ȼ�գ���ͨ��ʹ�û�����Դ������SO2���ŷţ�
��3����SO2�ܺ�ˮ��Ӧ��������������SO2�ĺ������ͣ��ڷ���Խ��������ɢ�ٶ�Խ��SO2Ũ��Ҳ��ԽС��

 ͬ��ѧ��һ�ζ���ϵ�д�
ͬ��ѧ��һ�ζ���ϵ�д� �����ܾ�ϵ�д�
�����ܾ�ϵ�д� ���ƿ�����ϵ�д�
���ƿ�����ϵ�д� ���¿쳵����������ϵ�д�
���¿쳵����������ϵ�д�����Ŀ���ס��ҡ�������������ת����ϵ��ͼ��ʾ(��Ӧ������ȥ����ͷ��ʾһ��ת��)�����и��������У���������ͼ��ʾת����ϵ����

�� | �� | �� | �� | |
A | NH3 | Cl2 | N2 | H2 |
B | C | SiO2 | CO | CuO |
C | Al(OH)3 | NaOH��Һ | NaAlO2��Һ | CO2 |
D | �Ҵ����� | NaOH��Һ | �Ҵ� | ���� |
A. A B. B C. C D. D
����Ŀ��Ϊ��̽����ѧ��Ӧ���ʺͻ�ѧ��Ӧ�ȵ��й����⣬ij�о�С�����������ʵ�飺
ʵ��һ��
������ͼװ�òⶨ��ѧ��Ӧ���ʣ���֪��S2O32-+2H+�TH2O+S��+SO2����

��1������ͼװ����ʾ��ʵ����Ʒ�⣬����Ҫ��һ��ʵ����Ʒ��________��
A.�¶ȼ� B.��� C.�ƾ���
��2������2minʱ�ռ���224mL��������ɱ�״�������壬�ɼ������2min��H+�ķ�Ӧ���ʣ����òⶨֵ��ʵ��ֵƫС����ԭ����__________��
ʵ�����
Ϊ̽�ַ�Ӧ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬��Ƶ�ʵ�鷽�����±�������֪I2+2S2O32-�TS4O62-+2I-������Na2S2O3��Һ��������
ʵ����� | ���V/mL | ʱ��/s | |||
Na2S2O3��Һ | ������Һ | ��ˮ | ˮ | ||
�� | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
�� | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
�� | 6.0 | 2.0 | 4.0 | Vx | t3 |
��3������Vx=____mL��t1��t2��t3�Ĵ�С��ϵ��________��
ʵ������
ȡ5mL0.1mol/L��KI��Һ���Թ���,�μ�0.1 mol��L��1 FeCl3��Һ��Һ2mL,�������·�Ӧ��2Fe3����2I��==2Fe2����I2.Ϊ֤���÷�Ӧ�ﵽһ���������Ҿ�����,�������������ʵ�飺
��ȡ������ӦҺ,�μ�AgNO3��Һ,������������ɫ��AgI��������
����ȡ������ӦҺ,�μ�����CCl4,��,����CCl4����dz��ɫ.
���ݢ٢ڵ�����,���ǵó����ۣ��÷�Ӧ����һ���Ŀ�����,��һ�������»�ﵽ��Ӧ��.
��4��ָ����ʦָ����������ʵ���Тٲ�����,����Ϊ��ԭ����___________ ���Ľ��ķ�����__________ ��
��5��������Ϊ������ʺϼ�������I2�϶�������,����һ�ּ�㷽�����������ؼ����Ƿ�������I2,���ַ������õ��Լ���______________________ ��




