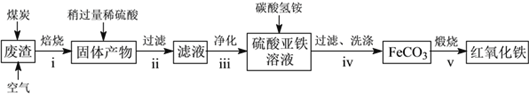
题目内容
【题目】“84消毒液”与硫酸溶液反应可以制取氯气,反应方程式为NaClO+NaCl+H2SO4![]() Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学设计了如下所示的实验装置。
Na2SO4+Cl2↑+H2O。为探究氯气的性质,某同学设计了如下所示的实验装置。

(1)在该实验中,制取氯气的装置是________(填字母)。

(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是____________________,请提出合理的改进方法______________________。
(3)D中的现象是___________________,反应的离子方程式为__________________________________,分离D中液体的方法是___________________________________________。
(4)写出氯气与NaOH溶液反应的离子方程式_________________,该反应中氧化剂与还原剂的物质的量之比为________。为验证尾气吸收后的溶液中存在Cl,正确的操作是_____________________。
(5)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明Cl2与H2O反应的产物中含有________。
【答案】(1)c
(2)Cl2中混有少量H2O(g) 在A~B之间增加装有浓H2SO4的洗气瓶
(3)下层CCl4层呈紫红色 Cl2+2I===I2+2Cl分液
(4)Cl2+2OH===Cl+ClO+H2O 1∶1 取少量烧杯内吸收Cl2后的溶液,加入足量的稀HNO3酸化,再加入AgNO3溶液,若有白色沉淀生成,证明其中含有Cl
(5)盐酸
【解析】
(1)根据“固+液![]() 气”原理可知应选择c装置制取Cl2。
气”原理可知应选择c装置制取Cl2。
(2)布条褪色证明Cl2中混有H2O(g),生成了HClO,应增加除H2O(g)的装置。
(3)Cl2+2I===I2+2Cl,CCl4将I2萃取出来,I2溶于CCl4,溶液呈紫红色,分离两种互不相溶的液体采用分液法。
(4)Cl2与NaOH溶液反应的离子方程式为Cl2+2OH===Cl+ClO+H2O,根据反应前后氯元素化合价变化可知Cl2既作氧化剂,又作还原剂,且物质的量之比为1∶1;检验Cl,应先用稀HNO3酸化中和溶液中的OH,并将ClO转化为HClO,再加AgNO3溶液,若有AgCl白色沉淀生成,证明含有Cl。
(5)因酸性HCl>H2CO3>HClO,HCl与NaHCO3反应:HCl+NaHCO3===NaCl+H2O+CO2↑,而HClO不与NaHCO3反应,故氯气与H2O反应的产物中含盐酸。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】要使工业废水中的重金属Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 | PbSO4 | PbCO3 | PbS |
溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
由上述数据可知,选用沉淀剂最好为( )
A. 硫化物 B. 硫酸盐
C. 碳酸盐 D. 以上沉淀剂均可
【题目】某研究性学习小组同学拟分析某市空气的质量情况,测定该市空气中SO2的含量并制定下列研究方案:
Ⅰ.资料表明,SO2具有较强的还原性,能与高锰酸钾酸性溶液发生反应:5SO2+2![]() +2H2O===5
+2H2O===5![]() +2Mn2++4H+。
+2Mn2++4H+。
Ⅱ.设计实验方案:利用SO2的还原性使SO2和已知浓度及体积的高锰酸钾酸性溶液反应。
Ⅲ.选择分析地点:某工业区、某公园、某居民小区、某商业区、某交通枢纽。
Ⅳ.选择分析时间:晴天、风速较小时;晴天、风速较大时;雨前;雨后。
Ⅴ.对测定的结果进行初步分析并向相关单位提出建议。
(1)该小组同学拟用如图所示装置定量分析空气中SO2的含量。
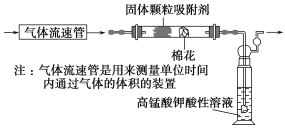
①通入空气前应进行的实验操作是________________________________;
②当观察到实验的现象为________________________________________时,应停止通空气;
③实验过程中需测量并记录的数据是_________________________________。
(2)如图表示该小组同学根据实验测得的该市不同地区空气中SO2的含量。
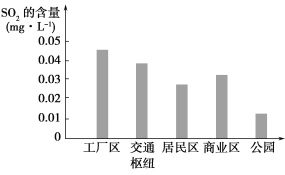
①工厂区、交通枢纽SO2含量明显高于其他地区的原因是_____________;
②请向当地有关部门提出一条减少工厂区SO2排放的建议:__________________________。
(3)下表是该小组同学测得的不同天气情况下的城市空气中SO2的平均含量。请分析雨后或风速较大时SO2平均含量较低的原因:
天气情况 | 平均风速(m·s1) | 空气中SO2的平均含量(mg·L1) |
雨前 | 2.0 | 0.03 |
雨后 | 2.2 | 0.01 |
晴 | 23 | 0.015 |
晴 | 0.9 | 0.03 |
①_____________________________________________________;
②_____________________________________________________。