题目内容
【题目】下列各组物质按混合物、电解质、非电解质的顺序排列的是( )
A.盐酸、氢氧化钠醋酸、干冰
B.澄清的石灰水、铜、氨气
C.石油、水、硫酸钡
D.海水、氯化钠、氧气
【答案】A
【解析】解:A、盐酸是HCl的水溶液,故为混合物;氢氧化钠在水溶液中能导电,故为电解质;干冰即二氧化碳,在水溶液中和熔融状态下均不能导电,故为非电解质,故A正确;B、铜是单质,既不是电解质也不是非电解质,故B错误;
C、硫酸钡在熔融状态下能导电,故为电解质,故C错误;
D、氧气是单质,既不是电解质也不是非电解质,故D错误.
故选A.

【题目】要使工业废水中的重金属Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:
化合物 | PbSO4 | PbCO3 | PbS |
溶解度/g | 1.03×10-4 | 1.81×10-7 | 1.84×10-14 |
由上述数据可知,选用沉淀剂最好为( )
A. 硫化物 B. 硫酸盐
C. 碳酸盐 D. 以上沉淀剂均可
【题目】某研究性学习小组同学拟分析某市空气的质量情况,测定该市空气中SO2的含量并制定下列研究方案:
Ⅰ.资料表明,SO2具有较强的还原性,能与高锰酸钾酸性溶液发生反应:5SO2+2![]() +2H2O===5
+2H2O===5![]() +2Mn2++4H+。
+2Mn2++4H+。
Ⅱ.设计实验方案:利用SO2的还原性使SO2和已知浓度及体积的高锰酸钾酸性溶液反应。
Ⅲ.选择分析地点:某工业区、某公园、某居民小区、某商业区、某交通枢纽。
Ⅳ.选择分析时间:晴天、风速较小时;晴天、风速较大时;雨前;雨后。
Ⅴ.对测定的结果进行初步分析并向相关单位提出建议。
(1)该小组同学拟用如图所示装置定量分析空气中SO2的含量。
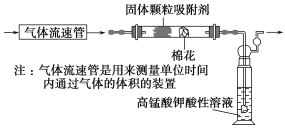
①通入空气前应进行的实验操作是________________________________;
②当观察到实验的现象为________________________________________时,应停止通空气;
③实验过程中需测量并记录的数据是_________________________________。
(2)如图表示该小组同学根据实验测得的该市不同地区空气中SO2的含量。
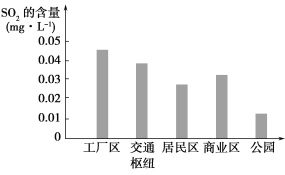
①工厂区、交通枢纽SO2含量明显高于其他地区的原因是_____________;
②请向当地有关部门提出一条减少工厂区SO2排放的建议:__________________________。
(3)下表是该小组同学测得的不同天气情况下的城市空气中SO2的平均含量。请分析雨后或风速较大时SO2平均含量较低的原因:
天气情况 | 平均风速(m·s1) | 空气中SO2的平均含量(mg·L1) |
雨前 | 2.0 | 0.03 |
雨后 | 2.2 | 0.01 |
晴 | 23 | 0.015 |
晴 | 0.9 | 0.03 |
①_____________________________________________________;
②_____________________________________________________。


