题目内容
【题目】磷酸是重要的化学试剂和工业原料。请回答下列问题:
(1)已知:25℃时,磷酸和氢氟酸的电离常数如下表所示。
物质 | H3PO4 | HF |
电离常数 | Ka1=7.1×10-3;Ka2=6.3×10-8;Ka3=4.2×10-13 | Ka=6.6×10-4 |
向NaF溶液中滴加少量H3PO4溶液,反应的离子方程式为___。
(2)已知:Ⅰ.CaO(s)+H2SO4(l)CaSO4(s)+H2O(l) ΔH=-271kJmol-1
Ⅱ.5CaO(s)+3H3PO4(l)+HF(g)Ca5(PO4)3F(s)+5H2O(l) ΔH=-937kJmol-1
则:①工业上用Ca5(PO4)3F和硫酸反应制备磷酸的热化学方程式为___。
②一定条件下,在密闭容器中只发生反应Ⅱ,达到平衡后缩小容器容积,HF的平衡转化率___(填“增大”“减小”或“不变”,下同);HF的平衡浓度___。
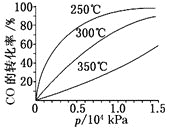
(3)工业上用磷尾矿制备Ca5(PO4)3F时生成的副产物CO可用于制备H2,原理为CO(g)+H2O(g)CO2(g)+H2(g) ΔH。
①一定温度下,向10L密闭容器中充入0.5molCO和1molH2O(g),2min达到平衡时,测得0~2min内用CO2表示的反应速率v(CO2)=0.02molL-1min-1。则CO的平衡转化率α=___;该反应的平衡常数K=___。
②在压强不变的密闭容器中发生上述反应,设起始的(![]() )=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___0(填“>”“<”或“=”,下同)。a___1,理由为___。
)=y,CO的平衡体积分数(φ)与温度(T)的关系如图所示。则:该反应的ΔH___0(填“>”“<”或“=”,下同)。a___1,理由为___。

【答案】H3PO4+F-=H2PO4-+HF Ca5(PO4)3F(s)+5H2SO4(l)![]() 3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418kJmol-1 增大 不变 80%
3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418kJmol-1 增大 不变 80% ![]() < < 相同温度下,
< < 相同温度下,![]() 越小,CO的转化率越大,其平衡体积分数越小
越小,CO的转化率越大,其平衡体积分数越小
【解析】
(1)根据电离平衡常数可知磷酸的酸性强于HF,HF的酸性强于磷酸二氢根,因此向NaF溶液中滴加少量H3PO4溶液发生反应生成H2PO4-和HF;
(2)①已知:Ⅰ.CaO(s)+H2SO4(l)CaSO4(s)+H2O(l)△H=-271kJmol-1;Ⅱ.5CaO(s)+3H3PO4(l)+HF(g)Ca5(PO4)3F(s)+5H2O(l)△H=-937kJmol-1;则根据盖斯定律,可知Ⅰ×5-Ⅱ可得Ca5(PO4)3F(s)和硫酸反应制备磷酸的热化学方程式;
②反应Ⅱ的正反应体积减小,达到平衡后缩小容器容积,平衡向正反应方向移动,考查判断HF的转化率变化;温度不变,平衡常数不变;
(3)①测得 0~2min内用 CO2表示的反应速率v(CO2)=0.02molL-1min-1,所以生CO2浓度是0.04mol/L,则
CO(g)+H2O(g)CO2(g)+H2(g)
初始(mol/L)0.05 0.1 0 0
转化(mol/L)0.04 0.04 0.04 0.04
平衡(mol/L)0.01 0.06 0.04 0.04
据此计算CO的平衡转化率α和该反应的平衡常数K;
②根据图象可知升高温CO的体积分数增大,说明平衡向正反应方向进行,该反应为放热反应;
相同温度下,![]() 越小,CO的转化率越大,其平衡体积分数越小,据此判断a。
越小,CO的转化率越大,其平衡体积分数越小,据此判断a。
(1)根据电离平衡常数可知磷酸的酸性强于HF,HF的酸性强于磷酸二氢根,因此向NaF溶液中滴加少量H3PO4溶液发生反应的离子方程式H3PO4+F-=H2PO4-+HF;
故答案为:H3PO4+F-=H2PO4-+HF;
(2)①已知:Ⅰ.CaO(s)+H2SO4(l)CaSO4(s)+H2O(l)△H=-271kJmol-1
Ⅱ.5CaO(s)+3H3PO4(l)+HF(g)Ca5(PO4)3F(s)+5H2O(l)△H=-937kJmol-1
则根据盖斯定律,可知Ⅰ×5Ⅱ可得:Ca5(PO4)3F(s)和硫酸反应制备磷酸的热化学方程式为:Ca5(PO4)3F(s)+5H2SO4(l)![]() 3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418kJmol-1;
3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418kJmol-1;
故答案为:Ca5(PO4)3F(s)+5H2SO4(l)![]() 3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418kJmol-1;
3H3PO4(l)+HF(g)+5CaSO4(s) ΔH=-418kJmol-1;
②反应Ⅱ的正反应体积减小,所以达到平衡后缩小容器容积平衡向正反应方向减小HF的平衡转化率增大;由于温度不变,平衡常数不变,即K=c(HF)),因此HF的平衡浓度不变;
故答案为:增大;不变;
(3) ①测得 0~2min内用 CO2表示的反应速率v(CO2)=0.02molL-1min-1,所以生CO2浓度是0.04mol/L,则
CO(g)+H2O(g)CO2(g)+H2(g)
初始(mol/L)0.05 0.1 0 0
转化(mol/L)0.04 0.04 0.04 0.04
平衡(mol/L)0.01 0.06 0.04 0.04
因此CO的平衡转化率α=![]() ×100%=80%;
×100%=80%;
该反应的平衡常数K=![]() =
=![]()
故答案为:80%;![]() ;
;
②根据图象可知升高温CO的体积分数增大,说明平衡向正反应方向进行,所以该反应的△H<0;
由于相同温度下,![]() 越小,CO的转化率越大,其平衡体积分数越小,所以a<1;
越小,CO的转化率越大,其平衡体积分数越小,所以a<1;
故答案为:<;<;相同温度下,![]() 越小,CO的转化率越大,其平衡体积分数越小。
越小,CO的转化率越大,其平衡体积分数越小。

【题目】尿素[CO(NH2)2]是含氮量最高的氮肥。
(1)已知工业上合成尿素的反应分为 如下两步:
第1步:2NH3(1)+CO2(g)![]() H2NCOONH4(1) ΔH1=-330.0kJmol-1
H2NCOONH4(1) ΔH1=-330.0kJmol-1
第2步:H2NCOONH4(1)![]() H2O(1)+CO(NH2)2(1) ΔH2=+226.3kJmol-1
H2O(1)+CO(NH2)2(1) ΔH2=+226.3kJmol-1
则下列各图能正确表示尿素合成过程中能量变化曲线的是___(填字母编号)。
A.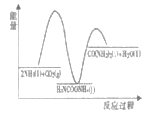 B.
B.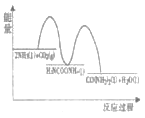
C.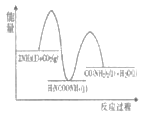 D.
D.
(2)一定条件下工业合成尿素的总反应:CO2(g)+2NH3(g)![]() CO(NH2)2(g)+H2O(g),t℃时,向容积恒定为2L的密闭容器中加入0.20molCO2和0.80molNH3,反应中CO2的物质的量随时间变化如下表所示:
CO(NH2)2(g)+H2O(g),t℃时,向容积恒定为2L的密闭容器中加入0.20molCO2和0.80molNH3,反应中CO2的物质的量随时间变化如下表所示:
时间/min | 0 | 40 | 70 | 80 | 100 |
n(CO2)/mol | 0.20 | 012 | 0.10 | 0.10 | 0.10 |
①前40min内v(NH3)=___,此温度下该反应的平衡常数为___。
②30min时v正(CO2)___80min时v逆(H2O)(选填“>”,“=”或“<”)。
③在100min时,保持其它条件不变,再向容器中充入0.10molCO2和0.40molNH3,重新建立平衡后CO2的转化率与原平衡相比将___(填“增大”、“不变”或“减小”)。
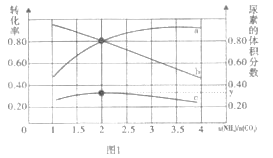
④氨碳比[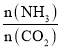 ]对合成尿素有影响,恒温恒容条件下将总物质的量为3mol的NH3和CO2的混合气体按不同的氨碳比进行反应,结果如图1所示。ab线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化[
]对合成尿素有影响,恒温恒容条件下将总物质的量为3mol的NH3和CO2的混合气体按不同的氨碳比进行反应,结果如图1所示。ab线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化[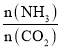 ]=___时,尿素产量最大;经计算,图中y=___(精确到0.01)。
]=___时,尿素产量最大;经计算,图中y=___(精确到0.01)。
(3)工业生产中为提高尿素的产率可采取的措施有___。
(4)近期科学家发现微生物可将生产废水中的尿素直接转化为对环境友好的两种物质,其工作原理如图2所示。回答下列问题:
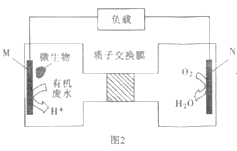
①N极为___板(填“正”或“负”),M电极反应式___。
②N极消耗标准状况下336L气体时,M极理论上处理的尿素的质量为___g。