题目内容
【题目】H3PO4是三元酸,如图是在常温下溶液中含磷微粒的物质的量分数(δ)随pH变化示意图。下列说法不正确的是( )

A.磷酸的第二级电离平衡常数约为10-7.2
B.在NaH2PO4溶液中:c(HPO42-)>c(H3PO4-)
C.在磷酸中滴加NaOH溶液至pH=7,c(Na+)=2c(HPO42)+c(H2PO4)
D.Na3PO4溶液中:c(Na+)=3c(PO43-)+3c(HPO42-)+3c(H2PO4-)+3c(H3PO4)
【答案】C
【解析】
A. 磷酸的第二级电离平衡常数Ka2=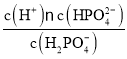 ,当c(H2PO4-)=c(HPO42-)时,Ka2=c(H+)=10-7.2,A正确;
,当c(H2PO4-)=c(HPO42-)时,Ka2=c(H+)=10-7.2,A正确;
B.在NaH2PO4溶液中:存在H2PO4-的电离平衡和水解平衡,电离产生H+使溶液显酸性,水解产生OH-和H3PO4,使溶液显碱性,但盐电离和水解程度是微弱的,主要以盐电离产生的离子存在,所以溶液中微粒浓度:c(HPO42-)>c(H3PO4),B正确;
C.在磷酸中滴加NaOH溶液至pH=7,根据电荷守恒可得c(Na+)+c(H+)=2c(HPO42) + c(H2PO4-)+3c(PO43-)+c(OH-),由于溶液显中性,所以c(H+)=c(OH-),则c(Na+)=2c(HPO42) + c(H2PO4-)+3c(PO43-)>2c(HPO42)+c(H2PO4-),C错误;
D.在Na3PO4溶液中:根据物料守恒可得:c(Na+)=3c(PO43-)+3c(HPO42-)+3c(H2PO4-)+3c(H3PO4),D正确;
故合理选项是C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目