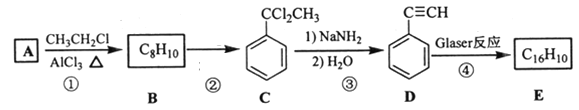
题目内容
【题目】还原沉淀法是处理含铬(含Cr2O72-和CrO42-)工业废水的常用方法,过程如下:

已知:转化过程中的反应为2CrO42-(aq)+2H+(aq)![]() Cr2O72-(aq)+H2O(l)。常温下Ksp[Cr(OH)3]=1×10-32。下列说法错误的是( )
Cr2O72-(aq)+H2O(l)。常温下Ksp[Cr(OH)3]=1×10-32。下列说法错误的是( )
A.反应①v正(CrO42-)=2v逆(Cr2O72-)时,反应处于平衡状态
B.反应②转移0.6mole-,则有0.2mol Cr2O72-被还原
C.除去废水中含铬离子的过程包括氧化还原反应和复分解反应
D.常温下,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,反应③应调溶液pH=5
【答案】B
【解析】
由转化关系可知,铬酸根在酸性条件下转化为重铬酸根,重铬酸根在酸性条件下与亚铁离子发生氧化还原反应生成铬离子,铬离子在碱性条件下生成氢氧化铬沉淀,达到处理含铬工业废水的目的。
A. 反应①v正(CrO42-)=2v逆(Cr2O72-)时,说明正反应速率等于逆反应速率,反应处于平衡状态,故A正确;
B. 反应②中反应1mol Cr2O72-,转移6 mole-,若反应转移0.6mole-,则有0.1mol Cr2O72-被还原,故B错误;
C. 重铬酸根在酸性条件下与亚铁离子发生氧化还原反应生成铬离子,铬离子在碱性条件下生成氢氧化铬沉淀属于复分解反应,则除去废水中含铬离子的过程包括氧化还原反应和复分解反应,故C正确;
D. 常温下,要使处理后废水中的c(Cr3+)降至1×10-5mol·L-1,则溶液中c(OH—)=![]() = 1×10-9mol·L-1,溶液pH=5,故D正确;
= 1×10-9mol·L-1,溶液pH=5,故D正确;
故选B。

练习册系列答案
相关题目