题目内容
【题目】用活性炭还原法可以处理氮氧化物。某研究小组向2L密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) △H<0。在T1℃时,反应进行到不同时间测得各物质的浓度(mol/L)如表所示,则下列说法不正确的是
N2(g)+CO2(g) △H<0。在T1℃时,反应进行到不同时间测得各物质的浓度(mol/L)如表所示,则下列说法不正确的是
时间/t(min) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
A. 10~20 min内,NO的平均反应速率为0.018mol/(Lmin)
B. T1℃时,该反应的平衡常数K=0.25
C. 保持与前30min的反应条件相同,再向容器中加入2molN2和2molNO,则平衡向左移动
D. 30min后,只改变了一个条件,根据上述表格判断,该条件可能为缩小容器体积
【答案】C
【解析】
A. 10~20 min内,NO的浓度从0.68变为0.50,反应了0.18,经历了10min,![]() ,A项不符合题意;
,A项不符合题意;
B. T1℃时,20min时已经达到平衡,可用20min的数据计算平衡常数![]() ,B项不符合题意;
,B项不符合题意;
C.利用浓度商Qc,再增加2molN2和2molNO,N2和NO的浓度变为1.25和1.5, 带入数据,![]() ,Qc<K,正向移动,向右进行;C项符合题意;
,Qc<K,正向移动,向右进行;C项符合题意;
D. 缩小容器体积,但是反应前后气体体积不变,平衡不移动,浓度改变的程度相同,0.50变成0.60,变为原来的1.2倍,则CO2和N2为0.3,也为原来的1.2倍,D项不符合题意;
本题答案选C。

 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下
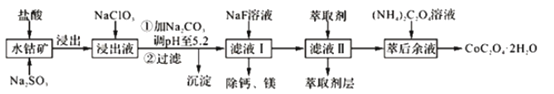
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)CoC2O4·2H2O中C的化合价是____________________________。
(2)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:______________。
(3)浸出液中加入NaClO3的目的是____________________________。
(4)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是______________(填化学式),试用离子方程式和必要的文字简述其原理:____________________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是______________;其使用的适宜pH范围是______________。
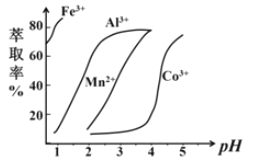
A. 2.02.5
B. 3.03.5
C. 4.04.5
(6)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。己知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量 NaF后,所得滤液 c(Mg2+)/c(Ca2+) =______________。
(7)用m1kg水钴矿(含Co2O360%)制备CoC2O4·2H2O,最终得到产品m2kg,产率(实际产量/理论产量×100%)为____________________________。(已知:M(Co2O3)=166, M(CoC2O4·2H2O)=183,仅需列出数字计算式)。
【题目】NaCl和NaClO在酸性条件下可发生反应:ClO-+Cl-+2H+=Cl2↑+H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO。写出化学反应方程式___。
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过以下装置检验气体的成分可以判断消毒液是否变质。
限选试剂:98%浓硫酸、1%品红溶液、1.0mol·L-1KI淀粉溶液、1.0mol·L-1NaOH溶液、澄清石灰水、饱和NaCl溶液。
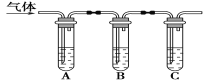
请完成下列实验方案。
所加试剂 | 预期现象和结论 |
试管A中加足量①___; 试管B中加1%品红溶液; 试管C中加②___。 | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊,则消毒液部分变质;③___,则消毒液未变质;④___,则消毒液完全变质。 |