题目内容
【题目】短周期元素X、Y、Z、W、Q原子序数依次增大。已知:X的最外层电子数是次外层的2倍,在地壳中Z的含量最大,W是短周期元素中原子半径最大的主族元素,Q的最外层比次外层少2个电子。请回答下列问题:
(1)X的价层电子排布式是___,Q的原子结构示意图是____。
(2)Y、Z两种元素中,第一电离能较大的是(填元素符号)_____,原因是______。
(3)Z、W、Q三种元素的简单离子的半径从小到大排列的是________。
(4)关于Y、Z、Q三种元素的下列有关说法,正确有是_______;
A.Y的轨道表示式是:
B.Z、Q两种元素的简单氢化物的稳定性较强的是Z
C. Z、Q两种元素简单氢化物的沸点较高的是Q
D.Y常见单质中σ键与π键的数目之比是1:2
(5)Q与Z形成的化合物QZ2,中心原子Q的杂化类型是_____,QZ2易溶于水的原因是________。
【答案】2s22p2 ![]() N N原子的2p轨道为半充满结构,能量低稳定 r(Na+)<r(O2-) <r(S2-) BD sp2杂化 SO2是极性分子,H2O是极性溶剂,相似相溶;SO2与H2O反应生成易溶于水的H2SO3
N N原子的2p轨道为半充满结构,能量低稳定 r(Na+)<r(O2-) <r(S2-) BD sp2杂化 SO2是极性分子,H2O是极性溶剂,相似相溶;SO2与H2O反应生成易溶于水的H2SO3
【解析】
X的最外层电子数是次外层的2倍,则次外层只能是K层,容纳2个电子,最外层是L层,有4个电子,X为C元素。地壳中Z的含量最大,则Z为O元素,X、Y、Z原子序数依次增大,则Y为N元素。W是短周期元素中原子半径最大的主族元素,W为Na。Q的最外层比次外层少2个电子,Q的次外层为L层,有8个电子,Q的最外层为M层,有6个电子,Q为S元素。
(1)X为C元素,核外电子排布为1s22s22p2,价层电子排布式为2s22p2;Q为S元素,16号元素,原子结构示意图为![]() ;
;
(2)Y为N元素,Z为O元素,第一电离能大的是N元素,原因是N原子的2p轨道为半充满结构,能量低稳定;
(3)Z、W、Q形成的离子分别为O2-、Na+、S2-。O2-和Na+具有相同的核外电子排布,核电荷数越大,半径越小,则有r(Na+ )<r(O2-)。O和S同主族,同主族元素形成的简单离子半径从上到小依次增大,有r(O2-) <r(S2-),则排序为r(Na+ )<r(O2-) <r(S2-);
(4)Y为N,Z为O,Q为S ;
A.Y的2p轨道上有3个电子,根据洪特原则,电子排布在能量相同的各个轨道时,电子总是尽可能分占不同的原子轨道,且自旋状态相同,2p轨道上的3个电子,应该分别在3个不同的轨道;A项错误;
B.O的氢化物H2O的稳定性比S的氢化物H2S的稳定性强,因为O非金属性比S的强;B项正确;
C.O的氢化物H2O的沸点比S的氢化物H2S的沸点高,原因是水分子间存在氢键;C项错误;
D.Y的单质为N2,N和N原子之间有3对共用电子对,其中σ键有1个,π键有2个,比例为1:2,D项正确;
本题答案选BD;
(5)QZ2为SO2,中心原子S的价电子有6个,配位原子O不提供电子,对于SO2,VP=BP+LP=2+![]() =3,中心S原子为sp2杂化;根据相似相溶的原理,SO2易溶于水是由于SO2是极性分子,H2O是极性溶剂,相似相溶;另外SO2与H2O反应生成易溶于水的H2SO3。
=3,中心S原子为sp2杂化;根据相似相溶的原理,SO2易溶于水是由于SO2是极性分子,H2O是极性溶剂,相似相溶;另外SO2与H2O反应生成易溶于水的H2SO3。

 名校课堂系列答案
名校课堂系列答案【题目】下列实验主要仪器和试剂的选择不能达到实验目的的是
选项 | 主要仪器 | 试剂 | 实验目的 |
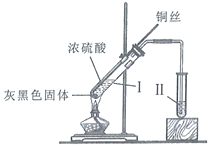
A | 烧瓶、长颈漏斗、酒精灯、导管 | 软锰矿与浓盐酸 | 制取并收集干燥的氯气 |
B | 酒精灯、玻璃棒、蒸发皿、三脚架 |
| 蒸发溶液得到晶体 |
C | 圆底烧瓶、导气管、烧杯、铁架台 | 干燥的氨气、水 | 模拟喷泉实验 |
D | 铁丝、蓝色钴玻璃、酒精灯 | 盐酸、待测液 | 焰色反应实验 |
A.AB.BC.CD.D