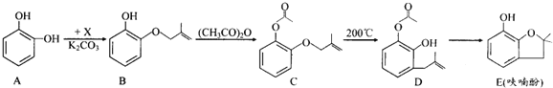
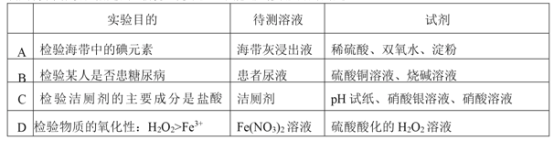
��Ŀ����
����Ŀ��ij��ĿѧϰС����ʵ��ʧ����ȡƯ�ۣ���̽��������ʯ���鷴Ӧ�������Ͳ����֪��
�ٶ���������Ũ���ᷴӦ���Ʊ�������ͬʱ����MnCl2��
�������ͼ�ķ�ӦΪ���ȷ�Ӧ.�¶Ƚϸ�ʱ�������ͼ�ܷ������·�Ӧ��3Cl2+6OH-![]() 5Cl-+ClO3-+3H2O��
5Cl-+ClO3-+3H2O��
����ĿС�����������ʵ��װ�ã�����ʵ�顣
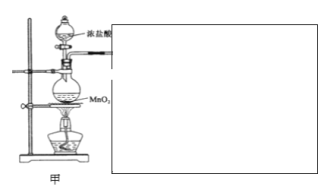
��ش��������⣺
��1����װ�������Ʊ�������
�����㽫װ����ͼ�з����в�������___(����������ҩƷ��
�ڸ���ĿС����100mL12mol/L������8.7gMnO2�Ʊ��������������������������ʯ���鷴Ӧ���������������Ƶ�Ca(ClO)2�����ʵ���Ϊ___��
��2��С���Ա���֣�������Ca(ClO)2����������С������ֵ���������ۺ���Ϊ��ԭ���ж���
�ٲ�������δ��ʯ���鷴Ӧ���ݳ���
��___��
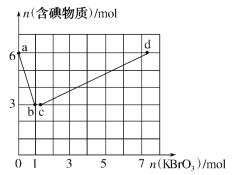
��3��Ϊ��̽����Ӧ�����Բ����Ӱ�죬������ȡһ������ʯ���飬�������ٵ�ͨ�������������ó���ClO-��ClO3-�������ӵ����ʵ�����n���뷴Ӧʱ�䣨t���Ĺ�ϵ���ߣ����Ա�ʾΪ��ͼ��������������ˮ�ķ�Ӧ����
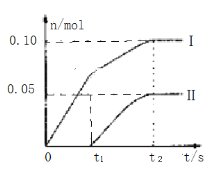
��ͼ������I��ʾ___���ӵ����ʵ����淴Ӧʱ��仯�Ĺ�ϵ��
����ȡʯ�����к���Ca(OH)2�����ʵ���Ϊ___��
����ȡһ����ڵ����ʵ�����ʯ���飬�Խϴ������ͨ��������������Ӧ���ò�����Cl-�����ʵ���Ϊ0.37mol���������![]() =___�����ֵ����
=___�����ֵ����
���𰸡� 0.05mol ������NaOH�ķ�Ӧ�Ƿ��ȷ�Ӧ����Һ�¶����ߣ�������Ca��ClO3��2��ʹ������Ca��ClO��2���������� ClO- 0.25 7��6
0.05mol ������NaOH�ķ�Ӧ�Ƿ��ȷ�Ӧ����Һ�¶����ߣ�������Ca��ClO3��2��ʹ������Ca��ClO��2���������� ClO- 0.25 7��6
��������
����ʵ��ԭ������װ��ͼ�����ݷ�Ӧ����ʽ������ؼ��㣻����������ԭ��Ӧ�е���ת���غ㼰ԭ���غ������ؼ��㡣
��1����Ũ����Ͷ������̷�Ӧ�����лᷢ���Ȼ������壬����ͨ������ʳ��ˮ��ȥCl2�л��е�HCl���壬Ϊ�˷�ֹ����Ӧ������������ʯ����ķ�Ӧ���Է��ڱ�ˮ�н��У���ֹ�¶����߷�������Ӧ�������ж���������Ҫ������������Һ����β���������ʴ�Ϊ��
��������Ũ������8.7g MnO2�Ʊ��������������������������ʯ���鷴Ӧ���������������Ƶ�Ca��ClO��2���������ݷ�ӦMnO2+4HCl��Ũ��=MnCl2+Cl2��+2H2O��2Cl2+2Ca��OH��2�TCaCl2+Ca��ClO��2+2H2O���õ�������ϵ��8.7g MnO2���ʵ���Ϊ0.1mol��2MnO2��Ca��ClO��2��n(Ca��ClO��2)=![]() n(MnO2)=
n(MnO2)=![]() ���ʴ�Ϊ��0.05mol��
���ʴ�Ϊ��0.05mol��
��2�����������Ϣ֪��������NaOH�ķ�Ӧ�Ƿ��ȷ�Ӧ����Һ�¶����ߣ�������Ca��ClO3��2��ʹ������Ca��ClO��2���������٣��ʴ�Ϊ��������NaOH�ķ�Ӧ�Ƿ��ȷ�Ӧ����Һ�¶����ߣ�������Ca��ClO3��2��ʹ������Ca��ClO��2���������٣�
��3���ٵ��¶ȵ�ʱ���������������Ʒ�Ӧ�����Ȼ��ƺʹ�����ƣ����¶ȸ�ʱ����������ƺ��Ȼ��ƣ��տ�ʼ��Ӧʱ���¶Ƚϵͣ��������������Ʒ�Ӧ�����Ȼ��ƺʹ�����ƣ�����ͼ2������I��ʾ����ClO-�����ʵ����淴Ӧʱ��仯�Ĺ�ϵ���ʴ�Ϊ��ClO-��
�ڸ���������ԭ��Ӧ�е�ʧ��������ȼ���Cl-�����ʵ������豻��ԭ�������ӵ����ʵ���Ϊn����n��1=0.10mol��1+0.05mol��5=0.35mol���������ӵ����ʵ���Ϊ��0.35mol+0.1mol+0.05mol=0.5mol���Ȼ��ơ�������ơ�������и����Ӻͺ������ӵĸ�����Ϊ1��2��������ȡʯ�����к���Ca��OH��2�����ʵ���Ϊ0.25mol���ʴ�Ϊ��0.25��
��ȡһ����ڵ����ʵ�����ʯ���飬���ʵ���Ϊ0.25mol������������ԭ��Ӧ�е�ʧ��������ȣ����������ӵõ����Ӻ����ɴ�������������ʧȥ�ĵ����غ㣬��n��ClO-��=x��n��ClO3-��=y����õ���0.37=x��1+y��5�������Ȼ��ơ�������ơ�������и����Ӻͺ���Ԫ�ص����ʵ�����Ϊ1��2���õ���Ԫ�����ʵ���Ϊ0.5mol��x+y+0.37=0.5����ã�x=0.07mol��y=0.06mol���������![]() =7��6���ʴ�Ϊ��7��6��
=7��6���ʴ�Ϊ��7��6��

 ���ѵ����Ԫ��ĩ���100��ϵ�д�
���ѵ����Ԫ��ĩ���100��ϵ�д�����Ŀ��(1)��ҵ����ȡ������CuCl2��2H2O����Ҫ������
�ٽ�������ͭ(������Fe)�ܽ���ϡ�����У����ȡ����ˣ�������Һ��pHΪ3��
�ڶ���������Һ�����в�����в�����
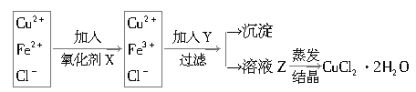
��֪��
���� | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp/25 �� mol3��L��3 | 8.0��10��16 | 2.2��10��20 | 4.0��10��38 |
��ȫ����ʱ��pH��Χ | ��9.6 | ��6.4 | 3��4 |
��ش��������⣺
�ټ����������X�������������ѡ�õ��� ______ ��
A��KMnO4 B��H2O2 C����ˮD��HNO3
�ڼ���Y��������___________________________��Y�Ļ�ѧʽΪ____________��
����Һ���������ᾧʱӦע�⣺________________________________��
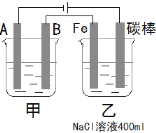
(2)��ͼΪ������ļס����������أ��Իش��������⣺
�׳���Ϊ�õ��ԭ������ͭ��װ�ã���������19.2 g�����ҳ������ų������ڱ�״���µ����Ϊ__________L��������������ܽ������