题目内容
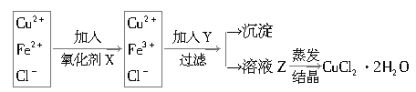
【题目】(1)工业上制取纯净的CuCl2·2H2O的主要过程是
①将粗氧化铜(含少量Fe)溶解于稀盐酸中,加热、过滤,调节滤液的pH为3;
②对①所得滤液按下列步骤进行操作:
已知:
物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
Ksp/25 ℃ mol3·L-3 | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
请回答下列问题:
①加入的氧化剂X,下列物质最好选用的是 ______ .
A.KMnO4 B.H2O2 C.氯水D.HNO3
②加入Y的作用是___________________________,Y的化学式为____________。
③溶液乙在蒸发结晶时应注意:________________________________。
(2)如图为相互串联的甲、乙两个电解池,试回答下列问题:
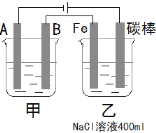
甲池若为用电解原理精炼铜的装置,阴极增重19.2 g,则乙池阳极放出气体在标准状况下的体积为__________L(不考虑气体的溶解情况)
【答案】BC 调节PH值使Fe3+沉淀完全 CuO或Cu(OH)2或CuCO3 或Cu2(OH)2CO3 在HCl气流中加热蒸发 6.72
【解析】
(1)①根据流程,加入氧化剂X后,只有Fe2+被氧化成Fe3+,没有引入新的杂质,据此分析;
②根据流程的目的,以及表格中的数据,加入Y的目的是调节pH,使Fe3+以Fe(OH)3形式沉淀出来,加入Y不能引入新的杂质,据此分析;
③Cu2+以水解,因此加热蒸发时注意防止Cu2+水解;
(2)该装置为电解池,根据电解原理,甲为精炼铜,A为阴极,纯铜作阴极,电极反应式为Cu2++2e-=Cu,B为阳极,粗铜作阳极,电极反应式为Cu-2e-=Cu2+,Fe为阴极,碳棒为阳极,书写出电极反应式,根据电子守恒进行计算;
(1)①加入氧化剂X后,除Fe2+转化成Fe3+外,其余离子不发生变化,试剂X可以是Cl2、H2O2等氧化剂,使用KMnO4引入K+、Mn2+杂质,使用HNO3,引入NO3-,且产生氮的氧化物,对环境与污染;
②加入Y后过滤,除去Fe元素,根据表格中数据,加入Y的目的是调节pH,使Fe3+以Fe(OH)3形式沉淀出来;加入的Y,能与H+发生反应,为不引入新杂质,加入物质不溶于水,即Y可以是CuO也可以是Cu(OH)2、CuCO3、Cu2(OH)2CO3;
③Cu2+能发生水解,加热促进其水解,因此蒸发结晶为防止Cu2+水解,需要在HCl气流中加热蒸发;
(2) 该装置为电解池,根据电解原理,甲为精炼铜,A为阴极,纯铜作阴极,电极反应式为Cu2++2e-=Cu,B为阳极,粗铜作阳极,电极反应式为Cu-2e-=Cu2+,Fe为阴极,碳棒为阳极,阳极反应式为2Cl-2e-=Cl2↑,根据得失电子数目守恒,建立Cu~2e-~Cl2↑,因此乙池中阳极放出气体在标准状况下的体积为![]() =6.72L。
=6.72L。

【题目】氨气是一种重要的化工原料,在工农业生产中有广泛的应用。
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:CO+2H2![]() CH3OH(g)。该可逆反应达到平衡的标志是________。
CH3OH(g)。该可逆反应达到平衡的标志是________。
A.2 v正(H2)= v逆(CH3OH)
B.单位时间生成m molCO的同时生成2m molH2
C.容器内气体的平均相对分子质量不再随时间而变化
D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取化工原料气氢气,某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2L的恒容密闭容器中,测得如下表所示数据。
时间/min | CH4(mol) | H2O(mol) | CO(mol) | H2(mol) |
0 | 0.40 | 1.00 | 0 | 0 |
5 | a | 0.80 | c | 0.60 |
7 | 0.20 | b | 0.20 | d |
10 | 0.21 | 0.81 | 0.19 | 0.64 |
请回答下列问题:
①该温度下,上述反应的平衡常数K=________;
②反应在7~10min内,CO的物质的量减少的原因可能是____________(填字母)。
A.减少CH4的物质的量 B.降低温度
C.升高温度 D.充入H2
③若保持相同的温度,向2L的恒容器密闭容器中同时充入0.2molCH4、0.62molH2O、a molCO和0.5molH2,当a =0.2时,上述反应向_____(填“正反应”或“逆反应”)方向进行。若要使上述反应开始时向逆反应方向进行,则a的取值范围为__________。