题目内容
10.钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染.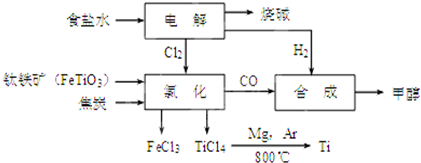
请回答下列问题:
(1)Fe位于元素周期表中第四周期,第ⅤⅢ族.
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO.
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2•x H2O,再经焙烧制得.水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:发生TiCl4+(2+x)H2O=TiO2•xH2O+4HCl,加入大量水并加热,HCl挥发,促使水解正向进行
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于1412℃即可.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g)?CH3OH(g).若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H25mol.
分析 (1)Ti的原子序数为22,根据核外电子排布式确定在周期表中的位置;
(2)分析流程可知,钛铁矿经氯化得到四氯化钛、氯化铁和一氧化碳,依据原子守恒配平书写;
(3)发生TiCl4+(2+x) H2O=TiO2•xH2O+4HCl,加入大量水并加热,HCl挥发,促使水解正向进行;
(4)依据图表数据中的数据分析,控制温度使TiCl4、Mg、MgCl2转化为蒸气,Ti不融化;
(5)根据n=cV计算n(Fe3+),根据电子转移守恒计算n(Ti3+),再根据Ti原子守恒计算n(TiO2),根据m=nM计算m(TiO2),进而计算TiO2的质量分数;
(6)根据甲醇的物质的量计算需要CO、H2的物质的量,根据n(CO)计算电解中生成的n(Cl2),进而计算电解生成n(H2),据此计算解答.
解答 解:(1)Fe的原子序数为26,原子核外电子排布为1s22s22p63s23p63d64s2,故处于第四周期第ⅤⅢ族,
故答案为:四、ⅤⅢ;
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO,
故答案为:2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO;
(3)发生TiCl4+(2+x) H2O=TiO2•xH2O+4HCl,加入大量水并加热,HCl挥发,促使水解正向进行;
故答案为:发生TiCl4+(2+x) H2O=TiO2•xH2O+4HCl,加入大量水并加热,HCl挥发,促使水解正向进行;
(4)依据图表数据分析可知,控制温度使TiCl4、Mg、MgCl2转化为蒸气,Ti不熔化,故温度略高于1412℃,
故答案为:1412;
(5)n(Fe3+)=c mol/L×V×10-3L=cV×10-3mol,根据电子转移守恒可知n(Ti3+)=n(Fe3+)=cV×10-3mol,再根据Ti原子守恒n(TiO2)=cV×10-3mol,故m(TiO2)=cV×10-3mol×Mg/mol=cVM×10-3g,故TiO2的质量分数为$\frac{cVM×1{0}^{-3}g}{wg}$×100%=$\frac{cVM}{10w}$%,
故答案为:$\frac{cVM}{10w}$%;
(6)由CO(g)+2H2(g)?CH3OH(g)可知,合成6mol甲醇需要n(CO)=6mol、n(H2)=12mol.根据2FeTiO3+6C+7Cl2$\frac{\underline{\;高温\;}}{\;}$2FeCl3+2TiCl4+6CO可知,电解中生成的n(Cl2)=$\frac{7}{6}$n(CO)=7mol,根据2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑可知,电解生成n(H2)=n(Cl2)=7mol,故需额外补充H2 为12mol-7mol=5mol,
故答案为:5.
点评 本题属于化学工艺流程题目,涉及结构与位置关系、常用化学用语、对工艺流程的理解与条件控制、滴定应用、电解原理、化学计算等,题目综合性较大,是一道不错的能力考查题目,要求学生具有扎实的基础与分析、解决问题的能力,难度中等.

 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案①是配制一定物质的量浓度的溶液的专用仪器
②使用前要先检查容量瓶是否漏液
③容量瓶可以用来加热
④不能用容量瓶贮存配制好的溶液
⑤可以用500mL容量瓶配制450mL溶液.
| A. | 除了③ | B. | ①②④ | C. | ③⑤ | D. | 除了⑤ |
| 选项 | 规律 | 结论 |
| A | 强酸可以制弱酸 | 氢硫酸(H2S)无法制取硫酸 |
| B | 反应物浓度越大,反应速度越快 | 常温下,相同的铝片分别加入到浓、稀硫酸中,浓硫酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随着相对分子质量增大而升高 | NH3的沸点低于PH3 |
| D | 溶解 度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴定KI溶液,会得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 都含有不饱和键 | |
| B. | 等质量的两种有机物完全燃烧时,所消耗氧气的质量相等 | |
| C. | 都能发生加成反应、取代反应和氧化反应 | |
| D. | 含有不同的官能团 |

 用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:?
用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题:?
 地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.
地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题.文献报道某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应,探究脱氮原理及相关因素对脱氮速率的影响.