题目内容
12. 为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如图实验,请回答下列问题:
为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如图实验,请回答下列问题:(1)装置A的分液漏斗中的试剂是浓盐酸,烧瓶中加入的试剂是MnO2.
(2)画出虚线框内的实验装置图,并注明所加试剂;该装置的作用除去Cl2中的HCl气体.
(3)装置B中的试剂是A(选填下列试剂),实验现象为有淡黄色沉淀生成.
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁.可说明氯元素比硫元素非金属性强的是B
A.全部 B.②③④⑥C.①②④⑤⑥D.除①以外
(5)从原子结构的角度简要分析氯元素的非金属性比硫元素的非金属性强的原因Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强.
分析 (1)从实验室制取氯气的原理:二氧化锰和浓盐酸加热反应生成氯气、氯化锰和水;
(2)从除杂质的角度:氯气中的氯化氢可以用饱和食盐水来除去;
(3)从置换反应判断元素非金属性强弱,氧化性强的单质可以置换氧化性弱的单质性;
(4)从判断元素非金属性强弱的方法:最高价氧化物对应水化物的酸性强弱、与氢气反应的难以程度、气态氢化物的稳定性等来判断元素非金属性的强弱;
(5)从原子结构的特点:氯原子的半径小于S原子半径,半径小,得电子能力强,据此回答;
解答 解:(1)为验证氯元素的非金属性比硫元素的非金属性强,需要用氯气置换出硫,则必须用装置A制备氯气,实验室通常用浓盐酸与二氧化锰反应制取氯气,则A装置中A的分液漏斗中盛装的试剂是浓盐酸,烧瓶中加入的试剂是MnO2,
故答案为:浓盐酸;MnO2;
(2)由于用浓盐酸制取氯气,且需要加热,即实验过程中要挥发出HCl气体,因此虚线框部分应是除去HCl气体的装置,可以使用洗气瓶,瓶内盛装饱和食盐水,既除去HCl,又降低氯气在水中的溶解度.所用装置为: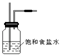 ,
,
故答案为: ,除去Cl2中的HCl气体;
,除去Cl2中的HCl气体;
(3)要在B中发生氯气置换出硫的反应,在给定试剂中只能选取Na2S溶液,发生的是置换反应,化学方程式为Na2S+Cl2=2NaCl+S↓,离子方程式为S2-+Cl2=2Cl-+S↓,
故答案为:A;有淡黄色沉淀生成;
(4)我们可从最高价氧化物对应水化物的酸性强弱、与氢气反应的难以程度、气态氢化物的稳定性等来判断元素非金属性的强弱,对Cl和S来说,可具体为:HClO4的酸性比H2SO4的酸性强;氯气的氧化性强于单质S的氧化性,或是S2-比Cl-易被氧化;还可以根据单质将变价金属氧化到的价态高低来确定单质的氧化性,进而确定元素得非金属性强弱,故答案为:B;
(5)从氯原子和硫原子的核外电子排布可知:Cl与S分别为第三周期元素的VIIA和VIA,原子半径:S>Cl,因为Cl的核电荷数大于S,Cl的原子核对最外层电子的吸引能力比S强,即Cl的电子能力比S强,非金属性Cl比S强.答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强.
故答案为:Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强;
点评 本题考查了实验装置的分析判断和氯气制备和性质的分析应用,应从实验装置着眼,从比较Cl和S的非金属性强弱着手,从整体的角度把握题目需要解答的问题,要通过本题建立解答本类题的正确思维过程,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| 选项 | 规律 | 结论 |
| A | 强酸可以制弱酸 | 氢硫酸(H2S)无法制取硫酸 |
| B | 反应物浓度越大,反应速度越快 | 常温下,相同的铝片分别加入到浓、稀硫酸中,浓硫酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随着相对分子质量增大而升高 | NH3的沸点低于PH3 |
| D | 溶解 度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴定KI溶液,会得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
①CuSO4 K2SO4 KNO3 KOH
②Na2CO3 BaCl2 HCl Na2SO4
③NH4NO3 Na2SO4 Ba(OH)2 AlCl3
④NaAlO2 Na2SiO3 H2SO4 NaCl.
| A. | ①②③ | B. | ①②③④ | C. | ①③④ | D. | ②③④ |
| A. | 氢氧化亚铁溶于稀硝酸中:Fe(OH)2+2H+═Fe2++2H2O | |
| B. | 三氧化二铁溶于氢碘酸:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 铝与氢氧化钠溶液反应:2AI+2OH-═2 AIO2-+H2↑ | |
| D. | 在氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
| A. | 质量 | B. | 原子总数 | C. | 密度 | D. | 分子数 |
| A. | 碳酸钙与稀硝酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 铜与硝酸银溶液反应:Cu+2Ag+═2Ag+Cu2+ | |
| C. | 铁溶于稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氢氧化钡溶液中滴加稀硫酸:Ba2++SO42-═BaSO4↓ |