题目内容
【题目】小组同学查阅资料,得到了Na2CO3(aq)与盐酸反应过程中的能量变化示意图如下。

(注:碳酸钠与碳酸氢钠的溶解过程的热效应忽略不计)
下列说法错误的是
A.△H1<△H2
B.若反应HCO3-+H+=CO2↑+H2O的熵增效应大于吸热效应,则其在常温下能自发进行
C.CO32-(aq)+2H+(aq) =CO2(g)+H2O(l)△H=(△H1+△H2-△H3) kJ/mol
D.相同条件下,结合H+的能力:CO32->HCO3-
【答案】C
【解析】
A、根据图像可知,△H1、△H2均为负数,而前者的绝对值大于后者,所以△H1<△H2,A正确;
B、熵增使反应自发,而焓增使反应不自发,若反应HCO3-+H+=CO2↑+H2O的熵增效应大于吸热效应,所以最终反应可以在常温下自发进行,B正确;
C、根据图像,CO32-(aq)+2H+(aq) =CO2(g)+H2O(l)是放热反应,所以△H=(△H1+△H2-△H3) kJ/mol,C错误;
D、结合氢离子的能力越强,则对应的酸越弱,所以相同条件下,结合H+的能力:CO32->HCO3-,D正确;
故答案选C。

 阅读快车系列答案
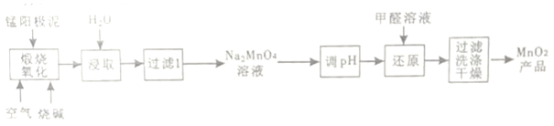
阅读快车系列答案【题目】Zn是一种应用广泛的金属。用闪锌矿(主要成分为ZnS,还含有SiO2和少量FeS、CdS、PbS、砷化合物杂质等)为原料制备金属Zn和ZnSO4·7H2O的流程如图所示:

①相关金属离子[c(Mn+)=0.1 mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Zn2+ | Cd2+ |
开始沉淀的pH | 1.5 | 6.3 | 6.2 | 7.4 |
沉淀完全的pH | 2.8 | 8.3 | 8.2 | 9.4 |
②FeAsO4难溶于水;ZnSO4·7H2O易溶于水,难溶于酒精。
回答下列问题:
(1)滤渣1的主要成分除SiO2外还有______,焙烧后产生的气体对环境造成的常见危害为______。
(2)氧化除杂工序中加入ZnO的作用是___________。
(3)制得的ZnSO4·7H2O需洗涤,洗涤晶体时应选用的试剂为____________。
(4)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为___________。不能省去“还原除杂”步骤,直接在“氧化除杂”步骤中除去Cd2+,理由是________。
(5)回收所得的Cd可用于制造镍镉碱性二次电池,电池工作时,正极NiO(OH)转化为Ni(OH)2,则充电时电池的阳极反应式为_____________;沉积锌后的电解液可返回______工序继续使用。
(6)酸浸液中砷元素以AsO33-存在,在氧化除杂时加入酸性KMnO4溶液,KMnO4可与AsO33-发生反应生成FeAsO4,写出该反应的离子方程式为___________。