题目内容
【题目】一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如下:
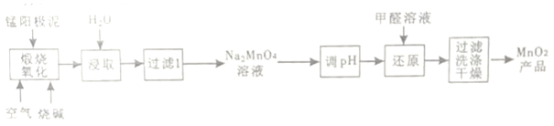
(1)“煅烧氧化”时,1mol MnO煅烧完全转化为Na2MnO4失去电子的物质的量为___________;MnO2煅烧反应的化学方程式为__________________。
(2)“浸取”时,为提高Na2MnO4的浸取率,可采取的措施有____________、____________(列举2点)
(3)“调pH”是将溶液pH 调至约为10,防止pH较低时Na2MnO4自身发生氧化还原反应,生成MnO2和___________;写出用pH试纸测定溶液pH的操作_______________。
(4)“还原”时有无机含氧酸盐生成,发生反应的化学方程式为_____________。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1. 准确称取mg产品,加入c1mol·L-1Na2C2O4溶液V1mL (过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2. 然后用c2mol·L-1KMnO4标准溶液滴定剩余的Na2C2O4滴定至终点时消耗KMnO4标准溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步骤2达滴定终点时判断依据是_____________;产品中MnO2的质量分数为ω(MnO2)=____________(列出计算的表达式即可)。
【答案】 4mol 2MnO2+4NaOH+O2![]() 2Na2MnO4+2H2O 煅烧后固体进行粉碎,适量增大水的量 适当提高浸取温度,充分搅拌 MnO4-(或NaMnO4) 取一小段pH试纸置于表面皿(点滴板上)中,用玻璃棒蘸取试液滴在pH试纸上,立刻与标准比色卡对照读出pH 2Na2MnO4+HCHO=2MnO2↓+Na2CO3+2NaOH 滴入最后一滴KMnO4溶液时,溶液呈浅红色且30s内不褪去
2Na2MnO4+2H2O 煅烧后固体进行粉碎,适量增大水的量 适当提高浸取温度,充分搅拌 MnO4-(或NaMnO4) 取一小段pH试纸置于表面皿(点滴板上)中,用玻璃棒蘸取试液滴在pH试纸上,立刻与标准比色卡对照读出pH 2Na2MnO4+HCHO=2MnO2↓+Na2CO3+2NaOH 滴入最后一滴KMnO4溶液时,溶液呈浅红色且30s内不褪去 ![]() ×100%
×100%
【解析】 (1)“煅烧氧化”时MnO![]() Na2MnO4锰由+2价变成+6价,失去电子为4e- ,1mol MnO煅烧完全失去电子的物质的量为4mol;MnO2煅烧反应的化学方程式为2MnO2+4NaOH+O2
Na2MnO4锰由+2价变成+6价,失去电子为4e- ,1mol MnO煅烧完全失去电子的物质的量为4mol;MnO2煅烧反应的化学方程式为2MnO2+4NaOH+O2![]() 2Na2MnO4+2H2O。
2Na2MnO4+2H2O。
(2)“浸取”时,为提高Na2MnO4的浸取率,就是增大化学反应速率,所以可采取的措施有:煅烧后固体进行粉碎,增大接触面积,适量增大水的量促进溶解,;适当提高浸取温度,加快化学反应速率,充分搅拌让物质充分迅速
(3)Na2MnO4中Mn的化合价为+6 ,MnO2中Mn的化合价为+4, Na2MnO4自身发生氧化还原反应,Mn的化合价为要升高,即发生MnO2 ![]() Na2MnO4
Na2MnO4 ![]() MnO4_,所以能生成MnO2,MnO4-(或NaMnO4)
MnO4_,所以能生成MnO2,MnO4-(或NaMnO4)
用pH试纸测定溶液pH的操作操作为(6). 取一小段pH试纸置于表面皿(点滴板上)中,用玻璃棒蘸取试液滴在pH试纸上,立刻与标准比色卡对照读出pH 。答案:MnO4-(或NaMnO4) 取一小段pH试纸置于表面皿(点滴板上)中,用玻璃棒蘸取试液滴在pH试纸上,立刻与标准比色卡对照读出pH 。
(4)由 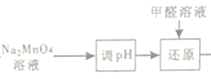 “还原指Na2MnO4与甲醛反应,发生反应的化学方程式为2Na2MnO4+HCHO=2MnO2↓+Na2CO3+2NaOH。
“还原指Na2MnO4与甲醛反应,发生反应的化学方程式为2Na2MnO4+HCHO=2MnO2↓+Na2CO3+2NaOH。
(5)达滴定终点时判断依据是:滴入最后一滴KMnO4溶液时,溶液呈浅红色且30s内不褪去。
由5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
5 2
X c2v2 X=![]() = 2.5C2V2
= 2.5C2V2
由Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4
1 1
C1V1-2.5C2V2 Y Y= (C1V1-2.5C2V2)mol
产品中MnO2的质量分数为m(MnO2)= (C1V1-2.5C2V2)mol![]() 87g/mol=87 (C1V1-2.5C2V2)/1000g
87g/mol=87 (C1V1-2.5C2V2)/1000g
产品中MnO2的质量分数为ω(MnO2)= 87(C1V1-2.5C2V2)/1000m![]() 100
100![]()