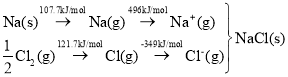题目内容
【题目】对于放热反应:H2+Cl2![]() 2HCl,下列说法中正确的是( )
2HCl,下列说法中正确的是( )
A.断开1molH—H键和1molC1—C1键所吸收的总能量大于形成2molH—C1键所放出能量
B.产物所具有的总能量高于反应物所具有的总能量
C.反应物所具有的总能量高于产物所具有的总能量
D.该反应中,化学能只转变为热能
【答案】C
【解析】
A.反应为放热反应,断键所吸收的能量小于成键所放出的能量,故断开1molH—H键和1molC1—C1键所吸收的总能量小于形成2molH—C1键所放出能量,A错误;
B.反应为放热反应,产物所具有的总能量应低于反应物所具有的总能量,B错误;
C.反应放热,故反应物所具有的总能量高于产物所具有的总能量,C正确;
D.该反应中,化学能不仅转化为热能,还转化为光能,D错误;
答案选C。

【题目】X、Y、Z、W为短周期元素,若W原子的最外层电子数是其内层电子的![]() ,如图所示,下列说法不正确的是
,如图所示,下列说法不正确的是
X | Y | |
Z | W |
A.X元素的氢化物分子间可以形成氢键
B.Y元素的两种同素异形体常温下都是气体
C.阴离子半径从大到小的顺序为X>Y>Z>W
D.最高价氧化物对应的水化物的酸性:W>Z
【题目】![]() 时,将
时,将![]() 的某一元酸HA与
的某一元酸HA与![]() 的NaOH溶液等体积混合,充分反应后所得溶液中部分离子浓度如下表。下列说法中正确的是
的NaOH溶液等体积混合,充分反应后所得溶液中部分离子浓度如下表。下列说法中正确的是![]()
微粒 |
|
|
|
浓度 |
|
|
|
A.所得溶液中:![]()
B.![]() 时,水的离子积
时,水的离子积![]()
C.![]() 时,一元酸HA的电离常数
时,一元酸HA的电离常数![]()
D.![]() 时,
时,![]() 溶液中
溶液中![]() 的水解率为
的水解率为![]()
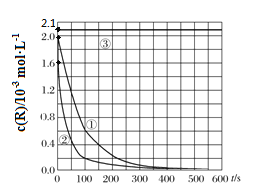
【题目】目前工业上处理有机废水的一种方法是:在调节好pH和Mn2+浓度的废水中加入H2O2,使有机物氧化降解。现设计如下对比实验(实验条件见下左表),实验测得有机物R浓度随时间变化的关系如下图所示。下列说法正确的是
实验编号 | T/K | pH | c/10-3mol·L-1 | |
H2O2 | Mn2+ | |||
① | 298 | 3 | 6.0 | 0.30 |
② | 313 | 3 | 6.0 | 0.30 |
③ | 298 | 9 | 6.0 | 0.30 |
A. 313K时,在0~100s内有机物R降解的平均速率为:0.014 mol·L-1·s-1
B. 对比①②实验,可以得出温度越高越有利于有机物R的降解
C. 对比①②实验,可以发现在两次实验中有机物R的降解百分率不同
D. 通过以上三组实验,若想使反应停止,可以向反应体系中加入一定量的NaOH溶液
【题目】称取58.7克Ba(OH)2和BaCl2固体混合物,配成500mL溶液,把该溶液分成5等份后分别加入相同浓度不同体积的NaHCO3溶液,生成沉淀的质量如下表。已知加入NaHCO3溶液体积为80.0mL时,反应后溶液呈中性。
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
NaHCO3溶液(mL) | 20.0 | 40.0 | 60.0 | 80.0 | 100.0 |
沉淀的质量(g) | 1.97 | 3.94 | 5.91 | 7.88 | 7.88 |
(1)NaHCO3溶液中溶质的物质的量浓度______________________。
(2)原固体混合物中Ba(OH)2和BaCl2的物质的量之比__________________________。