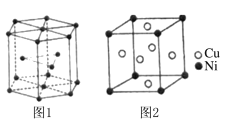
题目内容
【题目】生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应是Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。下列对铅蓄电池的说法错误的是( )
2PbSO4+2H2O。下列对铅蓄电池的说法错误的是( )
A.需要定期补充硫酸
B.工作时铅是负极,PbO2是正极
C.工作时负极上发生的反应是Pb-2e-+SO42-=PbSO4
D.工作时电解质的密度减小
【答案】A
【解析】
A、放电时消耗的硫酸与充电时生成的硫酸相等,说明H2SO4不用补充,故A不正确;
B、铅蓄电池放电时相当于原电池,Pb是负极,PbO2是正极,故B正确;
C、负极发生的反应是Pb失去电子生成Pb2+,Pb2+与溶液中的![]() 生成PbSO4沉淀,故C正确;
生成PbSO4沉淀,故C正确;
D、放电时,H2SO4被消耗,溶液中H2SO4的物质的量浓度减小,所以溶液的密度也随之减小,故D正确。
故选A。

【题目】氯气及其化合物在生产生活中有重要的应用。
(1)可用O2将HCl转化为Cl2:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。已知相关化学键的键能如下表所示
化学键 | H-Cl | O=O | Cl – Cl | H-O |
E(kJ·mol-1 | a | b | c | d |
则该反应的△H=______________。(用含a、b、c、d的代数式表示)
(2)氯气是有机合成中的重要试剂,丙烯(CH2=CHCH3)和Cl2在一定条件下发生如下反应: CH2=CHCH3 (g)+Cl2(g) ![]() CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)
CH2=CHCH2Cl(g)+HCl(g)。一定压强下,该反应在不同温度、不同投料比时,达平衡时Cl2的转化率如图所示(T12< T3)

①该反应的△H______________0(填“>”或“<”)
②下列措施能增大丙烯的平衡转化率的是______________ (填标号)。
A.降低温度 B.减小容器的体积
C.使用新型催化剂 D.从容器中移走氯化氢
③T1时,在容积为5L的密闭容器中充入0.15mol丙烯和0.10 molCl2,10min时达到平衡,则v(Cl2)为______________mol·〔L·min)-1,平衡常数K为______________,保持温度不变,减小投料比![]() ,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
,K值将______________ (填“增大”“减小”或“不变”);若起始时向该容器中充入0.30mol丙烯、0.20 molCl2、0.15 mol CH2=CHCH2Cl和0.30 molHCl,判断反应进行的方向并说明理由____________________________。
④上述反应在低于某温度时,CH2=CHCH2Cl的产率快速下降,可能的原因是____________________________。