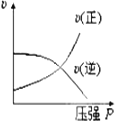
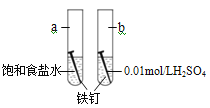
题目内容
【题目】铜锌原电池装置(见图),下列分析正确的是( )

A. 一段时间后两烧杯中c(Zn2+)、c(Cu2+)均减小
B. 原电池工作时,Cu电极流出电子,发生反应:Cu-2e-===Cu2+
C. 原电池工作时,Zn电极发生还原反应:Zn2++2e-===Zn
D. 原电池工作时的总反应为Zn+Cu2+===Zn2++Cu
【答案】D
【解析】
通过图像可知,此装置为原电池,Zn比Cu活泼,则Zn为负极, Cu为正极。
A.Zn为负极,反应为:Zn-2e-=Zn2+,溶液中的Zn2+离子浓度增大,A错误;B.Cu为正极,工作时电子流入,反应式:Cu2++2e-=Cu,B错误;C. 原电池工作时,Zn电极发生氧化反应,Zn-2e-=Zn2+,C错误;D.正负极得失电子数相等时,相加为总反应式,Zn+Cu2+===Zn2++Cu,D正确,答案为D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目