题目内容
1.如图是制取和收集某气体的实验装置,可用于( )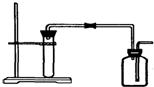
| A. | 用Zn粒与稀HCl反应制H2 | B. | 用大理石与稀HCl反应制CO2 | ||
| C. | 用Cu与稀HNO3反应制NO | D. | 用MnO2与浓HCl反应制Cl2 |
分析 该装置适合制备固体与液体不加热反应,气体密度小于空气密度,据此解答.
解答 解:A.Zn粒与稀HCl反应为固体与液体不加热,且氢气密度小于空气密度,故A正确;
B.二氧化碳密度大于空气密度,应选择长进短出收集,故B错误;
C.一氧化氮密度与空气中的氧气反应,不能用排气法收集,故C错误;
D.二氧化锰与浓盐酸反应需要加热,故D错误;
故选:A.
点评 本题考查了常见气体的制备,熟悉制备原理及气体性质是解题关键,注意发生装置和收集装置的选择,题目难度不大.

练习册系列答案
相关题目
12.下表为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)10种元素中,化学性质最不活泼的是Ar;
(2)④②⑤中,最高价氧化物的水化物,碱性最强的碱是KOH;
(3)②④⑦中形成的简单离子,半径由大到小的顺序是S2->K+>Ca2+;
(4)写出①与⑦形成的最简单化合物的电子式 .
.
(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为NaOH+Al(OH)3=Na[Al(OH)4]
(6)试比较与⑦与⑧两种元素最简单氢化物的沸点高低H2O>H2S.
(7)设计一个简单实验证明⑦⑨两种元素非金属性强弱的比较把溴水加到Na2S(或氢硫酸)溶液中,出现淡黄色沉淀;从而证明Br的非金属性强于S的.
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑧ | ||||||
| 3 | ① | ③ | ⑤ | ⑦ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)④②⑤中,最高价氧化物的水化物,碱性最强的碱是KOH;
(3)②④⑦中形成的简单离子,半径由大到小的顺序是S2->K+>Ca2+;
(4)写出①与⑦形成的最简单化合物的电子式
 .
.(5)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为NaOH+Al(OH)3=Na[Al(OH)4]
(6)试比较与⑦与⑧两种元素最简单氢化物的沸点高低H2O>H2S.
(7)设计一个简单实验证明⑦⑨两种元素非金属性强弱的比较把溴水加到Na2S(或氢硫酸)溶液中,出现淡黄色沉淀;从而证明Br的非金属性强于S的.
6.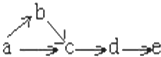 a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a是单质,b在通常状况下是气体,c、d都是氧化物,e是该元素的最高价氧化物对应水化物,且是一种强电解质,则a可能是( )
a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a是单质,b在通常状况下是气体,c、d都是氧化物,e是该元素的最高价氧化物对应水化物,且是一种强电解质,则a可能是( )
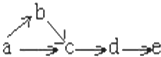 a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a是单质,b在通常状况下是气体,c、d都是氧化物,e是该元素的最高价氧化物对应水化物,且是一种强电解质,则a可能是( )
a、b、c、d、e五种物质均含有一种相同的元素,在一定条件下可发生如图所示转化,其中a是单质,b在通常状况下是气体,c、d都是氧化物,e是该元素的最高价氧化物对应水化物,且是一种强电解质,则a可能是( )| A. | C12 | B. | N2 | C. | S | D. | C |
13.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 100mL 1mol•L-1FeCl3溶液中含阳离子数为0.1NA | |
| B. | 标准状况下,2.24L乙醛完全燃烧所得CO2分子数为0.2NA | |
| C. | 0.6gCaCO3与KHCO3的混合物中所含质子数为0.3NA | |
| D. | 80Ml 10mol•L-1浓盐酸与足量MnO2反应,转移电子数为0.4NA |
10.下列说法正确的是( )
| A. | 常温下0.4 mol/L HB溶液与0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c (Na+)>c (B-)>c (H+)>c (OH-) | |
| B. | 常温时,pH均为2的CH3COOH溶液和HCl溶液,pH均为12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等 | |
| C. | 常温下0.1 mol/L的下列溶液 ①NH4Al(SO4)2、②NH4Cl、③NH3•H2O、④CH3COONH4中c (NH$_4^+$)由大到小的顺序是:②>①>④>③ | |
| D. | 0.1 mol/L NaHB溶液中其pH为4:c(HB-)>c(H2B)>c(B$_{\;}^{2-}$) |
11.下列说法正确的是( )
| A. | “纳米材料”是指微粒直径为几纳米到几十纳米的材料,故纳米材料是胶体 | |
| B. | 用丁达尔效应可区分胶体和溶液 | |
| C. | 分散剂一定是液体 | |
| D. | 将饱和FeCl3溶液滴入NaOH浓溶液中,可制得Fe(OH)3胶体 |
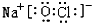 ;J的结构式
;J的结构式 .
. 随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.
随着科学技术的进步,人们研制出了多种类型的甲醇质子交换膜燃料电池,以满足不同的需求.