题目内容
【题目】某烃经催化加氢后得到2-甲基丁烷,该烃可能是
A. 3-甲基-1-丁烯B. 2-甲基丙烷
C. 2-甲基-1-丁烯D. 3,3-二甲基-1-丁烯
【答案】AC
【解析】
根据加成原理,不饱和键断开,结合H原子,生成2-甲基丁烷,采取倒推法相邻碳原子之间各去掉氢原子形成不饱和键,即得到不饱和烃。
2-甲基丁烷的碳链结构为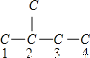 ;
;
A、若在3、4号碳原子之间为双键,则烃为3-甲基-1-丁烯,故A可以;
B、2-甲基丙烷是饱和烃,不能发生加成反应,不可能加氢得到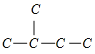 ,故B不可以;
,故B不可以;
C、若双键在1、2号碳原子之间,则烃为2-甲基-1-丁烯,故C可以;
D、2-甲基丁烷只有1个取代基,不可能由3,3-二甲基-1-丁烯加氢而得,故D不可以;
故选AC。

练习册系列答案
相关题目