题目内容
【题目】实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为:
2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
(1)请将上述化学方程式改写为离子方程式________________。
(2)浓盐酸在反应中显示出来的性质是________________(填写编号,多选倒扣)。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(3)此反应中氧化产物是_________(填化学式),产生0.5 mol Cl2,则转移的电子的物质的量为______mol。
(4) 用双线桥法表示该反应的电子转移的方向和数目
_____
2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O
【答案】 2MnO4—+16H++10Cl—===2Mn2++5Cl2↑+8H2O ② Cl2 1 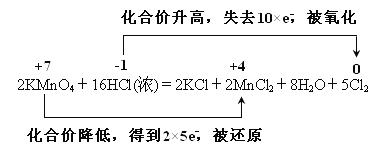
【解析】(1)反应中的盐和酸均易溶,拆成离子,单质和水不能拆,2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O的离子方程式为:2MnO4—+16H++10Cl—===2Mn2++5Cl2↑+8H2O;(2)浓盐酸在反应中显示出来的性质是还原性和酸性,答案选②;(3)此反应中盐酸被氧化生成氯气,氧化产物是Cl2;反应中氯元素从-1价变为0价,产生0.5 mol Cl2,则转移的电子的物质的量为1mol;(4) 用双线桥法表示该反应的电子转移的方向和数目如下: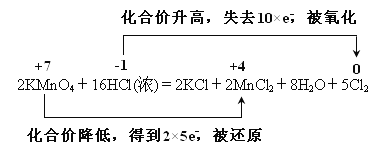 。
。

练习册系列答案
相关题目
【题目】下列陈述正确并且有因果关系的是
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | SO2有漂白性 | SO2可使溴水褪色 |
B | SiO2有导电性 | SiO2可用于制备光导纤维 |
C | 浓硫酸有强氧化性 | 浓硫酸可用于干燥H2和CO |
D | Fe3+有强氧化性 | FeCl3溶液可用于回收废旧电路板中的铜 |