题目内容
将2.72g铁和氧化铁的混合物加入足量的盐酸中充分反应后,固体无剩余,测得反应后放出标准状况下气体0.224 L.则下列判断中正确的是
| A.原混合物中n(Fe)∶n(Fe2O3)=3∶1 |
| B.反应后溶液中Fe2+和Fe3+的物质的量之比为3∶1 |
| C.实际参加反应HCl的物质的量为0.08mol |
| D.向溶液中滴入KSCN溶液,显红色 |
C
解析试题分析:铁和氧化铁的混合物加入足量的盐酸中,发生反应:①Fe2O3+6HCl=2FeCl3+3H2O,② Fe+2FeCl3=3FeCl2.③Fe+2HCl=FeCl2+H2↑因为n(H2)=0.224L∕22.4L·mol-1=0.01mol。所以发生地三个反应消耗的铁是m(Fe)=0.56g其余固体恰好发生①②反应。由这两个方程式可得关系式是:Fe2O3- Fe。质量关系是160份氧化铁对应56份铁。而总质量是2.72g-0.56g=2.16g.所以m(Fe2O3)=1.6g即n(Fe2O3)=0.01mol发生②反应的铁质量为:m(Fe)="0.56g," n(Fe)=0.01mol铁原子总物质的量为n(Fe)=0.01+0.01+0.01×2=0.04mol。最后溶液是FeCl2溶液。n(Cl-)="2" n(Fe)=0.08mol。所以n(HCl)=n(Cl-)=0.08mol。C正确。A中原混合物中n(Fe)∶n(Fe2O3)=(0.01+0.01)∶0.01=2:1.错误。由于最后溶液是FeCl2溶液,不含氯化铁,向溶液中滴入KSCN溶液,也不显红色所以B错误,D 错误。
考点:考查一种物质与多种物质的混合物反应时的先后顺序的知识。

在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如下图所示(b处NaOH溶液的体积为1L),则下列判断不正确的是( )
| A.NaOH的浓度为0.6mol/L |
| B.在a点处溶液中的溶质为NaCl |
| C.在b点处溶液中的溶质只有NaAlO2 |
| D.图中线段oa:ab=5:1 |
两份质量相同的铝片,分别与足量的盐酸和氢氧化钠溶液反应,在相同条件下分别产生的气体体积比是
| A.1:1 | B.2:3 | C.3:2 | D.1:6 |
下列有关金属元素及其化合物说法不正确的是
| A.铁和氯气反应生成三价铁,和盐酸反应生成亚铁离子 |
| B.铜在潮湿的空气中易生锈呈绿色,锈的主要成分是碱式碳酸铜 |
| C.过氧化钠和氧化钠均可以与水、二氧化碳反应,但生成的产物不完全相同 |
| D.等质量的铝分别与足量的酸和碱溶液反应,生成气体的体积一定相同 |
将由Mg和Al组成的一定质量的混合物投入500 mL 稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示。则下列说法正确的是
| A.上述由Mg和Al组成的混合物的质量为8g |
| B.硫酸的物质的量浓度为1 mol·L-1 |
| C.生成的H2在标准状况下的体积为11.2L |
| D.NaOH溶液的物质的量浓度为3.75 mol·L-1 |
金属钠着火时,可用来灭火的是
| A.二氧化碳 | B.水 | C.煤油 | D.沙土 |
(12分)某小组进行铝热反应实验,装置如图所示。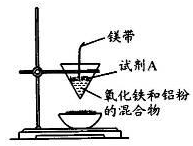
(1)铝热反应原理____(写化学方程式);试剂A为____(写化学式).实验现象____、有黑色固体生成。
(2)对黑色固体物质的组成,小组进行了如下探究
假设I该黑色物质为铁
假设Ⅱ该黑色物质为铁与四氧化三铁的混合物
【设计方案并实验】
| 实 验 步 骤 | 现 象 | 结 论 |
| ①取少量黑色固体于试管中加稀盐酸 | 固体全部溶解,有气泡产生 | 假设I成立,假设Ⅱ不成立 |
| ②滴入几滴0.01mol/LKSCN溶液 | 溶液不变色 |
你认为上述结论是否合理,__ __理由是__ __。
(3)取上述实验所得溶液,滴人适量氯水溶液变红色。此时涉及的离子反应方程式为
__ __、__ __;
利用反应体系中存在的平衡,小组再将溶液均分置于两支试管中并分别编号l、2.进行
如下探究:
| 实验编号 | 实验步骤 |
| 1 | ①滴加饱和FeCl3溶液4滴,充分振荡 |
| ②滴加几滴NaOH溶液 | |
| | ①滴加4滴1mol/LKSCN溶液 |
| ②滴加几滴NaOH溶液 |
主要探究的问题是__ __;
应重点观察的现象是__ __
预计得出的结论是__ __。
(12分)某研究性学习小组在网上搜集到信息:钾、钙、钠、镁等活泼金属能在CO2气体中燃烧。他们对钠在CO2气体中燃烧进行了下列实验:
| 操作过程 | 实验现象 |
| 将干燥的玻璃燃烧匙中燃烧的钠迅速 伸入到盛有装满CO2的集气瓶中 | 钠在盛有CO2的集气瓶中继续燃烧 |
| 反应后冷却 | 集气瓶底附着黑色颗粒,瓶壁上附着有白色 物质 |
a.水 b.泡沫灭火剂 c.干沙土 d.二氧化碳
(2)该小组同学对瓶壁上的白色物质的成分进行讨论并提出假设
I.白色物质是Na2O;
II.白色物质是Na2CO3;
III.白色物质还可能是
(3)
| 实验步骤 | 实验现象 |
| ①取少量白色物质于试管中,加入适量水,振荡,样品全 部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
②写出该反应的方程式 。
