题目内容
15.下列化合物中含有离子键的是( )| A. | CO2 | B. | NaCl | C. | CH4 | D. | H3PO4 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,碱金属族元素、碱土金属元素和第VIA族、第VIIA族元素之间易形成离子键,部分碱、大多数盐、金属氧化物及铵盐中都含有离子键,据此分析解答.
解答 解:A.二氧化碳分子中C-O原子之间只存在共价键,属于共价化合物,故A错误;
B.NaCl中钠离子和氯离子之间只存在离子键,属于离子化合物,故B正确;
C.甲烷分子中C-H原子之间只存在共价键,属于共价化合物,故C错误;
D.磷酸分子中P-O、H-O原子之间只存在共价键,属于共价化合物,故D错误;
故选B.
点评 本题考查离子键和共价键,侧重考查基本概念,明确物质构成微粒及微粒之间作用力即可解答,注意不能根据是否含有金属元素判断化学键,题目难度不大.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
6.未知物A的实验式和分子式都是C2H6O.A的红外光谱图如图(a),未知物A的核磁共振氢谱有三个峰图(b),峰面积之比是1:2:3,未知物A的结构简式为( )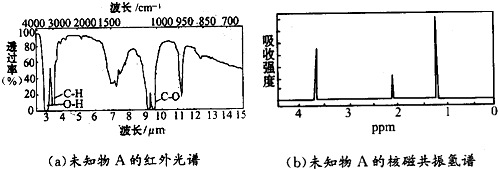

| A. | CH3CH2OH | B. | CH3OCH3 | C. | CH3 COOH | D. | CH3CHO |
3.32g铜跟适量的浓硝酸反应,铜全部作用后,共收集到NO、NO2混合气体22.4L(标准状况下),则反应消耗的硝酸的物质的量是( )
| A. | 1.0 mol | B. | 1.5 mol | C. | 2.0 mol | D. | 2.5 mol |
10.A和M为两种元素,已知A位于短周期,且A2+与M-的电子数之差为8,则下列说法正确的是( )
| A. | A和M的原子序数之差为6 | |
| B. | A和M原子的最外层电子数之差为7 | |
| C. | A和M原子的最外层电子数之和可能为9 | |
| D. | A和M原子的电子总数之和可能为11 |
20.下列烷烃化合物中,只有两种同分异构体的是( )
| A. | C2H6 | B. | C3H8 | C. | C4H10 | D. | C5H12 |
7.下列离子方程式正确的是( )
| A. | 稀硝酸与氢氧化钾溶液反应 H++OH-→H2O | |
| B. | 铝与稀盐酸反应 Al+2H+→Al3++H2↑ | |
| C. | 氯化铁溶液与氢氧化钠溶液反应 FeCl3+3OH-→Fe(OH)3↓+3C1- | |
| D. | 二氧化碳与石灰水反应 CO2+2OH-→CO32-+H2O |
4.有机物分子结构中基团之间的相互影响会导致物质化学性质的改变,下列各项的事实不能说明上述观点的是( )
| A. | 甲苯能使酸性高锰酸钾溶液褪色,而甲烷不能 | |
| B. | 乙醇电离出H+的能力不及H2O | |
| C. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| D. | 苯酚能与NaOH溶液反应,而乙醇不能与NaOH溶液反应 |
5.能增加反应物分子的活化分子的百分数,同时可以改变化学平衡常数的是( )
| A. | 升高温度 | B. | 使用催化剂 | C. | 增大压强 | D. | 增加浓度 |