题目内容
4.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )| A. | 1mol NH4+所含有的电子数为11 NA | |
| B. | 20g氖气所含有的分子数约为 3.01×1023 | |
| C. | 标准状况下,22.4LSO2气体所含的原子数为 NA | |
| D. | 常温常压下,32gO2和O3的混合气体所含原子数为2 NA |
分析 A、铵根离子为10电子微粒;
B、氖气为单原子分子;
C、求出二氧化硫的物质的量,然后根据1mol二氧化硫中含3mol原子来计算;
D、氧气和臭氧均由氧原子构成.
解答 解:A、铵根离子为10电子微粒,故1mol铵根离子中含10mol电子即10NA个,故A错误;
B、氖气为单原子分子,即氖气的摩尔质量为20g/mol,故20g氖气中氖气分子的物质的量n=$\frac{20g}{20g/mol}$=1mol,个数为6.02×1023个,故B错误;
C、标况下22.4L二氧化硫的物质的量为1mol,而1mol二氧化硫中含3mol原子,即3NA个,故C错误;
D、氧气和臭氧均由氧原子构成,故32g混合物中含有的氧原子的物质的量n=$\frac{32g}{16g/mol}$=2mol,个数为2NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案
相关题目
14.A gSO2与B gSO3所含氧原子个数相等,则A与B的比值为( )
| A. | 1:1 | B. | 2:3 | C. | 3:2 | D. | 6:5 |
15.某化学反应的能量变化如图所示.下列有关叙述正确的是( )
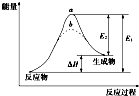

| A. | 逆反应的活化能小于正反应的活化能 | |
| B. | a、b分别对应有催化剂和无催化剂的能量变化 | |
| C. | 该反应的反应热△H=E2-E1 | |
| D. | 催化剂能改变反应的焓变 |
12.设 NA代表阿伏加德罗常数,下列说法中正确的是( )
| A. | 标准状况下,22.4L CO完全燃烧生成CO2分子数为NA | |
| B. | 17g 氨气所含电子数为NA | |
| C. | 在常温、常压下,11.2L氯气所含的原子数目为NA | |
| D. | 32g氧气所含的原子数目为NA |
19.铜镁合金1.52g完全溶解于50mL密度为1.40g•mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况).向反应后的溶液中加入1.0mol•L-1 NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
| A. | 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L-1 | |
| C. | 该合金中铜与镁的物质的量之比是2:1 | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
16.相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:A (g)+3B (g)?2C (g)△H=-50kJ/mol
实验测得起始、平衡时的有关数据如下表:
下列叙述正确的是( )
实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| A | B | C | ||
| (1) | 1 | 3 | 0 | 放出热量a kJ |
| (2) | 0 | 0 | 2 | 吸收热量b kJ |
| (3) | 2 | 6 | 0 | 放出热量c kJ |
| A. | A的体积分数:(2)>(1)>(3) | |
| B. | 三个容器内反应的平衡常数:K(3)=K2(1)=K2(2) | |
| C. | 达平衡时体系压强:P(3)=2P(1) | |
| D. | 热量关系:a+b=50 |