题目内容
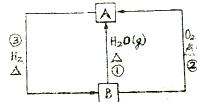
13.下列图示中,A为一种常见的单质,B,C,D,E是含A元素的常见化合物,她们的焰色反应均为黄色.请填写下列空白: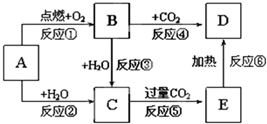
(1)以上反应中,属于氧化还原反应的有①②③④.(填写编号)
(2)写出化学式:ANa,BNa2O2,DNa2CO3.
(3)写出B→C反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑,写出C→E反应的化学方程式NaOH+CO2=NaHCO3.
分析 A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.它们的焰色反应均为黄色,则均为钠的单质或化合物,所以A为Na,结合转化关系可知,B为Na2O2,C为NaOH,D为Na2CO3,E为NaHCO3,然后结合单质及化合物的性质、化学用语来解答.
解答 解:A为一种常见的单质,B、C、D、E是含有A元素的常见化合物.它们的焰色反应均为黄色,则均为钠的单质或化合物,所以A为Na,结合转化关系可知,B为Na2O2,C为NaOH,D为Na2CO3,E为NaHCO3,
(1)以上反应中①为钠的燃烧,②为Na与水反应,③为过氧化钠与水反应,④为过氧化钠与二氧化碳反应,均属于氧化还原反应,⑤为复分解反应⑥为分解反应,不是氧化还原反应,故答案为:①②③④;
(2)由以上分析可知A为Na,B为Na2O2,D为Na2CO3,故答案为:Na;Na2O2;Na2CO3;
(3)B→C为过氧化钠与水的反应,生成氢氧化钠和氧气,反应的方程式为2Na2O2+2H2O=4NaOH+O2↑,C→E为氢氧化钠和二氧化碳的反应,生成碳酸氢钠,反应的方程式为NaOH+CO2=NaHCO3,故答案为:2Na2O2+2H2O=4NaOH+O2↑;NaOH+CO2=NaHCO3.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力的考查,明确焰色为黄色及A为单质为解答的突破口,熟悉钠及其化合物的性质是解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
4.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1mol NH4+所含有的电子数为11 NA | |
| B. | 20g氖气所含有的分子数约为 3.01×1023 | |
| C. | 标准状况下,22.4LSO2气体所含的原子数为 NA | |
| D. | 常温常压下,32gO2和O3的混合气体所含原子数为2 NA |
1.某新型氧燃料充电电池采用了特殊金属合金材料,可以将氢以固态形式存储在固态金属合金(M表示固态金属合金) 与通常的压缩氢气罐相比,其安全系数的基且易于氢气的充放.下列有关说法中正确的是( )
| A. | 该氢燃料充电电池是将电能转化为化学能 | |
| B. | 固态金属合金作还原剂 | |
| C. | 该电池工作过程中的总反应为H2+M═MH2 | |
| D. | 该电池反应的最终产物为H2O |
18.用一定量的MnO2与50mL 10mol/L 盐酸共热制取Cl2,在反应后的溶液中加入足量AgNO3溶液,过滤,洗涤,干燥后得57.4克白色固体则可制得氯气的体积(标准状态)是( )
| A. | 11.2升 | B. | 3.36升 | C. | 2.24升 | D. | 1.12升 |
18.实验室用废CuO(含有杂质FeO、Fe2O3)制备胆矾晶体,经历下列过程(Fe3+在pH=5时已完全沉淀):下列分析正确的是( )


| A. | 用98%的浓硫酸配制溶解所用的4.5mol•L-1的稀硫酸,只需3种玻璃仪器 | |
| B. | 步骤②目的是将溶液Ⅰ中的Fe2+充分转化成Fe3+,实验操作是向溶液Ⅰ中通入足量的氯气 | |
| C. | 步骤④之后的实验操作是蒸干溶剂结晶,所需仪器是蒸发皿、泥三角、三脚架 | |
| D. | 利用Cu(OH)2 替代CuO也可调节溶液pH而不影响实验结果 |

 .
. .
.