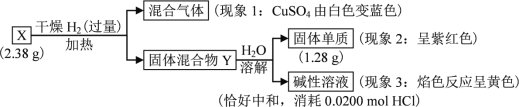
题目内容
【题目】下列叙述正确的是
A.恒容密闭容器中的反应3A(g)![]() B(g)+C(g),平衡后再充入少量A气体,A的转化率增大
B(g)+C(g),平衡后再充入少量A气体,A的转化率增大
B.SO2的催化氧化是一个放热的反应,所以升高温度,反应的速率减慢
C.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率
D.反应NH3(g)+HCl(g![]() NH4C1(s) ΔH<0,在任何条件下均能自发进行
NH4C1(s) ΔH<0,在任何条件下均能自发进行
【答案】A
【解析】
A.平衡后再充入少量A气体,相当于增大压强,平衡正向移动,A的转化率增大,A正确;
B.无论放热反应,还是吸热反应,升高温度,反应速率都加快,B错误;
C.常温下铁在浓硫酸中会钝化,C错误;
D.反应NH3(g)+HCl(g)![]() NH4C1(s) ΔH<0,S < 0,H—T·S<0的反应能自发进行,高温下该反应不能自发进行,D错误;
NH4C1(s) ΔH<0,S < 0,H—T·S<0的反应能自发进行,高温下该反应不能自发进行,D错误;
答案选A。

 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案【题目】常温下,将某一元酸![]() 甲、乙、丙、丁代表不同的一元酸
甲、乙、丙、丁代表不同的一元酸![]() 和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
实验 编号 | HA的物质的 量浓度 | NaOH的物质的 量浓度 | 混合后溶液的pH |
甲 |
|
| pH |
乙 |
|
| pH |
丙 |
|
|
|
丁 |
|
| pH |
![]() 从甲组情况分析,从a值大小如何判断HA是强酸还是弱酸?________________________________________________________________________。
从甲组情况分析,从a值大小如何判断HA是强酸还是弱酸?________________________________________________________________________。
![]() 乙组混合溶液中
乙组混合溶液中![]() 和
和![]() 的大小关系是________
的大小关系是________![]() 填标号
填标号![]() 。
。
A.前者大 ![]() 后者大
后者大
C.二者相等 ![]() 无法判断
无法判断
![]() 从丙组实验结果分析,该混合溶液中
从丙组实验结果分析,该混合溶液中![]() __________
__________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 分析丁组实验数据,写出该混合溶液中下列算式的精确结果
分析丁组实验数据,写出该混合溶液中下列算式的精确结果![]() 列式
列式![]() :
:![]() __________
__________![]() 。
。
【题目】相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)![]() 2SO3(g)△H=-197kJ/mol。实验测得起始、平衡时的有关数据如下表:
2SO3(g)△H=-197kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | |||
SO2 | O2 | SO3 | Ar | ||
甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
下列叙述正确的是
A.若在上述条件下反应生成2molSO3(s)的反应热为△H1,则△H1>-197 kJ·mol-1
B.Q1=Q2=Q3=197kJ
C.甲、乙、丙3个容器中反应的平衡常数不相等
D.达到平衡时,丙容器中SO2的体积分数最小