题目内容
【题目】如图所示,A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应。按图示接通线路,反应一段时间。
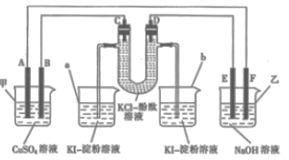
(1)甲池是________(填“原电池”或“电解池”,下同)装置;乙池是________装置。
(2)C极为________(填“阴极”或“阳极”)。
(3)烧杯中溶液会变蓝的是_________________(填“a”或“b”)。
(4)C极上的电极反应式为___________________________________。
(5)甲池中反应的化学方程式为______________________________。
【答案】 电解池 原电池 阳极 a 2Cl--2e-==Cl2↑ 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
【解析】A、B、C、D为石墨电极,E、F分别为短周期相邻两种活泼金属中的一种,且E能与NaOH溶液反应,则E为铝,F为镁。根据图示,装置乙为原电池,在镁、铝(NaOH溶液)原电池中铝为负极,镁为正极,即E为负极,F为正极,因此,D、B为阴极,A、C为阳极。
(1)根据上述分析,甲池是电解池;乙池是原电池,故答案为:电解池;原电池;
(2)C极与原电池的正极相连,为阳极,故答案为:阳极;
(3)中间装置为电解氯化钾溶液,C极为阳极,溶液中的氯离子放电生成氯气,因此a烧杯中氯气与碘化钾反应置换出碘,淀粉溶液变蓝,故答案为:a;
(4)根据(3)的分析,C极上的电极反应式为2Cl--2e-==Cl2↑,故答案为:2Cl--2e-==Cl2↑;
(5)甲池为电解硫酸铜溶液,阴极上铜离子放电生成铜,阳极上氢氧根离子放电生成氧气,反应的化学方程式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O
2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4。
2Cu+O2↑+2H2SO4。

 阅读快车系列答案
阅读快车系列答案【题目】A、B、C、D、E为前四周期元素,且原子序数依次增大
A | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
B | 地壳中含量最多的元素,2P轨道上有二个孤电子 |
C | 与B同主族 |
D | 前四周期中金属性最强的元素 |
E | 前四周期中原子核外孤电子数最多 |
(1)C元素位于第__________________周期__________________族,B元素的核外电子排布式为__________________,E元素的价电子排布图为__________________。
(2)B、C两元素的电负性大小关系为:__________________(用元素符号表示),A、B的最简单气态氢化物的稳定性强弱大小关系为:________________(用氢化物的化学式表示)。
(3)B的氢化物由固体变为气态所需克服的微粒间的作用有__________________。
(4)有A、B、C三种元素及氢元素组成的既含离子键又含共价键且其中元素C显最高价的酸式盐的化学式是__________________。
(5)D2B2的电子式为__________________,与CO2反应生成B的单质的化学方程式为:__________________。
(6)E2O72-具有强氧化性,可与含有C元素的某种还原性离子反应(该离子中C元素显+4价),在酸性条件下该反应的离子方程式为:__________________