题目内容
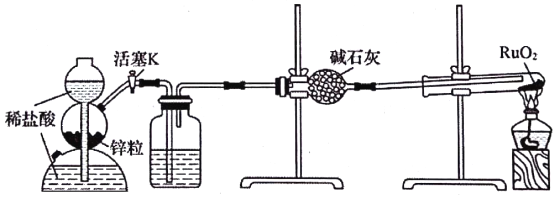
【题目】某同学利用反应Cu+2FeCl3=CuCl2+2FeCl2,设计了如图所示的原电池装置,下列说法正确的是( )
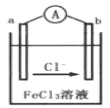
A. b为负极,发生还原反应
B. b电极反应式为2Fe3++2e-=Fe2+
C. 电子流动方向是a电极→FeCl3溶液→b电极
D. 电池的正极材料可以选用石墨、铂电极
【答案】D
【解析】
由方程式Cu+2FeCl3=CuCl2+2FeCl2可知,Cu被氧化,为原电池的负极,负极反应为Cu-2e-=Cu2+,正极Fe3+被还原,电极方程式为2Fe3++2e-=2Fe2+;原电池内部:阴离子向负极移动,阳离子向正极移动。
A. 根据氯离子移动方向,可以判断a为正极,发生还原反应;b为负极,发生氧化反应,故A错误;
B. b电极为负极,电极反应式为Cu-2e-=Cu2+,故B错误;
C. 电子流动方向是b电极出发经过外电路到达a电极,故C错误;
D.电池的正极材料可以选用石墨、铂电极等不活泼的导电材料,故D正确;
答案:D

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目