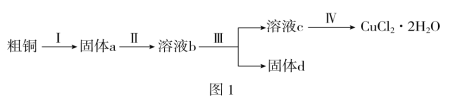
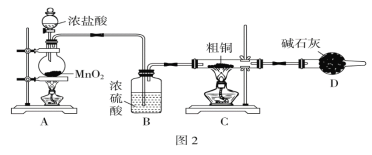
题目内容
【题目】如图是元素周期表的一部分,回答下列问题:
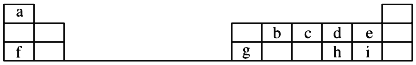
(1)元素e的负一价离子的结构示意图为__________,f、g、h、i对应简单离子的半径由大到小的顺序为____________________(用具体微粒符号表示)。
(2)元素i的单质溶于水,生成一种具有漂白作用的化合物,该化合物的电子式为____。
(3)b、c、d三种原子的得电子能力大小顺为_____________________(用具体微粒符号表示)。
【答案】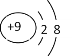 S2->Cl->Na+>Al3+
S2->Cl->Na+>Al3+ ![]() O>N>C
O>N>C
【解析】
根据元素周期表可知:a为H,b为C,c为N,d为O,e为F,f为Na,g为Al,h为S,i为Cl。
(1)元素e为F,负一价离子的结构示意图为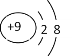 ;微粒半径的比较:①电子层数越多半径越大②电子层数相同时,核电荷数越大,吸电子能力越强,半径越小。因此f、g、h、i对应简单离子的半径由大到小的顺序为S2->Cl->Na+>Al3+;
;微粒半径的比较:①电子层数越多半径越大②电子层数相同时,核电荷数越大,吸电子能力越强,半径越小。因此f、g、h、i对应简单离子的半径由大到小的顺序为S2->Cl->Na+>Al3+;
答案: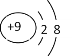 S2->Cl->Na+>Al3+
S2->Cl->Na+>Al3+
(2)元素i的单质为氯气,溶于水Cl2+H2O![]() HCl+HClO,生成一种具有漂白作用的化合物HClO,该化合物的电子式为
HCl+HClO,生成一种具有漂白作用的化合物HClO,该化合物的电子式为![]() ;
;
答案:![]()
(3)同一周期从左到右,非金属增强,因为非金属性越强,得电子能力越强,b、c、d三种原子的得电子能力大小顺为 O>N>C;
答案:O>N>C

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目