题目内容
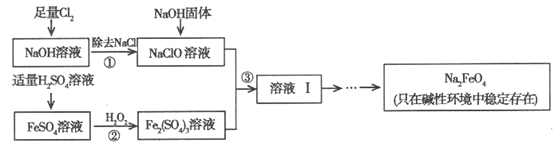
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是高铁电池的重要原料,也是一种新型的绿色净水消毒剂。工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
回答下列问题:
(1)Cl2与NaOH溶液反应的离子方程式是__________________。
(2)经过步骤①后,加入NaOH固体的原因是________________________。
(3)步骤②反应的离子方程式是_______________。
(4)从溶液I中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为_______________。
(5)Na2FeO4投入到污水中杀菌消毒,生成的Fe(OH)3可以起到絮凝剂的作用。通过计算得知Na2FeO4的消毒效率(以单位质量的消毒剂得到的电子数表示)比氯气的_________(填“高”或“低”),用高铁酸钠代替氯气作净水消毒剂的优点是_________(答出一点即可)。
(6)高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH放电时,负极的电极反应式是_____。正极附近溶液的碱性______(填“增强”、“不变”或“减弱”)。
3Zn(OH)2+2Fe(OH)3+4KOH放电时,负极的电极反应式是_____。正极附近溶液的碱性______(填“增强”、“不变”或“减弱”)。
【答案】Cl2+2OH-=Cl-+ClO-+H2O Na2FeO4只在碱性环境中稳定存在,NaOH调节pH 2Fe2++2H++H2O2=2Fe3++2H2O 2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O 低 方便保存,消毒的同时可以净水,无毒 Zn-2e-+2OH-=Zn(OH)2, 增强
【解析】
(1)Cl2与NaOH溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O;
(2)经过步骤①后,加入NaOH固体的原因是Na2FeO4只在碱性环境中稳定存在,NaOH调节pH;
(3)步骤②硫酸亚铁在双氧水作用下被氧化生成硫酸铁和水,反应的离子方程式是2Fe2++2H++H2O2=2Fe3++2H2O;
(4)从溶液I中分离出Na2FeO4后,还有副产品Na2SO4、NaCl,则步骤③中硫酸铁在碱性条件下被次氯酸钠氧化生成高铁酸钠,反应的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(5)FeO42-+3e-+4H2OFe(OH)3+5OH-,单位质量得到电子![]() =0.018,
=0.018,
Cl2+2e-═2Cl-,单位质量得到电子![]() =0.028,
=0.028,
所以Na2FeO4的消毒效率比氯气低;高铁酸钠代替氯气作净水消毒剂,利用氧化性起到杀菌消毒作用,利用生成的氢氧化铁胶体起到净水作用,答案为方便保存,消毒的同时可以净水,无毒;
(6)放电时,负极上锌失电子发生氧化反应,电极反应式为Zn-2e-+2OH-=Zn(OH)2;正极K2FeO4发生得电子的还原反应,即FeO42-+3e-+4H2O=Fe(OH)3+5OH-,正极附近溶液的碱性增强。

 名校课堂系列答案
名校课堂系列答案【题目】金属Na、Mg、Al有广泛的应用。
(1)Al在元素周期表中的位置是__________________。
(2)金属镁可以用来生产金属铀(元素符号是U):UF4+2Mg![]() U+2MgF2,该反应中,作为还原剂的物质是_________(填化学式,下同),被还原的物质是_________。
U+2MgF2,该反应中,作为还原剂的物质是_________(填化学式,下同),被还原的物质是_________。
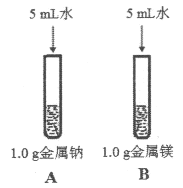
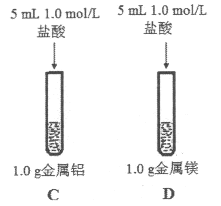
(3)为比较Na、Mg、Al的金属性,进行了如下实验(金属固体的表面积都相同):
实验1 | 实验2 |
|
|
钠与水反应剧烈,镁与水反应缓慢 | 镁与盐酸反应剧烈,铝与盐酸反应缓慢 |
由实验1和实验2得出的结论是:金属性_________>_________>_________(填元素符号),用原子结构理论解释:同周期元素从左到右,_________。
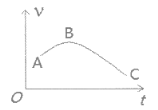
(4)把镁条(去除氧化膜)投入到盛有盐酸的敞口容器中,产生H2的速率v与时间t的关系如图所示,AB段速率增大的主要原因是__________________。