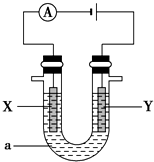
题目内容
5.下列有关电解质溶液的说法正确的是( )| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| C. | 在Na2C2O4稀溶液中,c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| D. | 0.1 mol/L Na2CO3溶液与0.1 mol/L NaHCO3溶液等体积混合:3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
分析 A.氨水为弱碱,一水合氨溶液在稀释10倍后电离程度增大,溶液的pH变化小于1;
B.碳酸氢根离子的酸性大于氢氧化铝,二者反应生成氢氧化铝沉淀和碳酸钠,不会生成气体;
C.根据a2C2O4溶液中的质子守恒判断;
D.根据混合液中的物料守恒分析.
解答 解:A.一水合氨为弱电解质,加水稀释,促进其电离,pH变化比强碱小,pH=a的氨水溶液,稀释10倍后,其pH=b,则a<b+1,故A错误;
B.向NaAlO2溶液中滴加NaHCO3溶液,反应生成氢氧化铝和碳酸钠,没有气体生成,故B错误;
C.在Na2C2O4稀溶液中,根据质子守恒可得:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),故C正确;
D.0.1mol/L Na2CO3溶液与0.1 mol/L NaHCO3溶液等体积混合,根据物料守恒可得:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒、质子守恒及盐的水解原理为解答关键,注意掌握弱电解质的电离特点及判断离子浓度大小常用方法,试题侧重考查学生的分析、理解能力及灵活应用基础知识的能力.

练习册系列答案
相关题目
13.有两组物质:①组CH4、聚乙烯、邻二甲苯 ②组2-丁烯、乙炔、苯乙烯下列有关上述有机物说法正确的是
( )
( )
| A. | ①组物质都不能使酸性高锰酸钾褪色,②组物质都能使酸性高锰酸钾褪色 | |
| B. | ①组物质都不能使溴的四氯化碳褪色,②组物质都能使溴的四氯化碳褪色 | |
| C. | ②组物质所有原子可以在同一平面内 | |
| D. | 邻二甲苯的一氯代物只有两种 |
10.加入铝粉有氢气产生的溶液中,可能大量共存的离子组是( )
| A. | Ba2+、Na+、I-、Fe3+ | B. | Mg2+、Cl-、NO3-、Al3+ | ||
| C. | K+、Cl-、HCO3-、SO42- | D. | Ba2+、Na+、Cl-、[Al(OH)4]- |
17.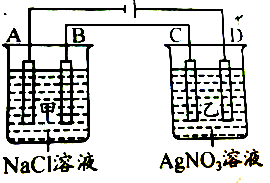 甲、乙两个容器中,分别加入0.1 mol•L -1的 NaCl溶液与0.1 mol•L-1的AgNO3溶液后,以 Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为 ( )
甲、乙两个容器中,分别加入0.1 mol•L -1的 NaCl溶液与0.1 mol•L-1的AgNO3溶液后,以 Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为 ( )
 甲、乙两个容器中,分别加入0.1 mol•L -1的 NaCl溶液与0.1 mol•L-1的AgNO3溶液后,以 Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为 ( )
甲、乙两个容器中,分别加入0.1 mol•L -1的 NaCl溶液与0.1 mol•L-1的AgNO3溶液后,以 Pt为电极进行电解时,在A、B、C、D各电极上生成物的物质的量之比为 ( )| A. | 2:2:4:1 | B. | 2:3:4:1 | C. | 1:4:2:2 | D. | 1:1:1:1 |
15.体积、物质的量的浓度均相等的NaCl和NaF两份溶液中阴离子总数关系正确的是( )
| A. | 前者多 | B. | 相等 | C. | 后者多 | D. | 无法判断 |
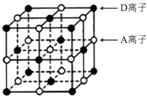 A、B、C、D为短周期主族元素,原子序数依次增大.A和D可形成化合物E,E的焰色反应呈黄色;B是地壳中含量最高的金属元素;C基态原子最外层原子轨道中有两个未成对电子且无空轨道.请回答下列问题:
A、B、C、D为短周期主族元素,原子序数依次增大.A和D可形成化合物E,E的焰色反应呈黄色;B是地壳中含量最高的金属元素;C基态原子最外层原子轨道中有两个未成对电子且无空轨道.请回答下列问题:
 X、Y、Z、W、Q五种前四周期元素,原子序数依次增大.已知X、Y、Z、W均为非金属元素,XW2分子与Y3-为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题:
X、Y、Z、W、Q五种前四周期元素,原子序数依次增大.已知X、Y、Z、W均为非金属元素,XW2分子与Y3-为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和,根据以上信息回答下列问题: .
.