题目内容
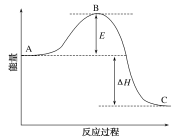
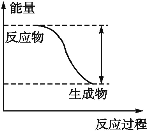
【题目】反应Fe+H2SO4![]() FeSO4+H2↑的能量变化趋势如图所示:
FeSO4+H2↑的能量变化趋势如图所示:
(1)该反应为____________(填“吸热”或“放热”)反应。
(2)若要使该反应的反应速率增大,下列措施可行的是____________(填字母)。
A.改铁片为铁粉B.改稀硫酸为98%的浓硫酸C.升高温度D.减小压强
(3)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为____________(填“正”或“负”)极。铜片上产生的现象为____________,该极上发生的电极反应为____________,铁电极的电极反应为____________,外电路中电子由____________(填“正”或“负”,下同)极向____________极移动。
【答案】放热 AC 正 产生无色气泡 2H++2e-![]() H2↑ Fe-2e-=Fe2+ 负 正
H2↑ Fe-2e-=Fe2+ 负 正
【解析】
(1)从反应物总能量和生成物总能量的相对大小判断是放热还是吸热反应;
(2)从影响速率的因素出发展开选择;
(3)应用原电池原理判断负极材料、负极反应、正极材料、正极反应即电子流动方向;
(1)由图:反应物总能量大于生成物总能量,则该反应为放热反应;
答案为:放热;
(2)A. 将铁片改为铁粉,增大反应物接触面积,化学反应速率加快,故正确;
B.将稀硫酸改为浓硫酸,浓硫酸和铁发生钝化现象而阻止氢气生成,故错误;
C.升高温度,化学反应速率加快,故正确;
D.改变压强,对有气体参加的反应速率有影响,减小压强,对该反应速率几乎没有影响,故错误;
答案为:AC;
(3)Cu、Fe和稀硫酸构成原电池,易失电子的金属Fe作负极,另一种金属Cu作正极;Cu电极上氢离子得电子生成氢气,所以看到的现象是有无色气体生成,电极反应式为2H++2e-═H2↑,铁电极上的反应为:Fe-2e-=Fe2+,电子由负极Fe流出,沿着导线流向正极Cu;
答案为:正;产生无色气泡;2H++2e-═H2↑;Fe-2e-=Fe2+;负;正。

 阅读快车系列答案
阅读快车系列答案【题目】欲配制250mL0.1molL-1的稀盐酸,实验室的浓盐酸密度为1.25gcm-3,质量分数为36.5%。
请回答下列问题:
(1)配制稀盐酸时下表中不需要使用的仪器有___(填序号),还缺少的仪器为___、___(写仪器名称)。
序号 | ① | ② | ③ | ④ | ⑤ | ⑥ |
仪器 |
|
|
|
|
|
|
(2)需要量取浓盐酸的体积为___mL。
(3)配制该溶液的操作顺序是:D→___→___→___→___→B(用字母符号表示,每个字母符号只用一次)。
A.用30mL蒸馏水洗涤烧杯和玻璃棒各2~3次,将洗涤液全部注入容量瓶中并轻轻摇动
B.将容量瓶盖紧,振满,摇匀
C.将已恢复至室温的盐酸沿玻璃棒注入所选用的容量瓶中
D.用量筒准确量取所需体积的浓盐酸,将其沿玻璃棒注入烧杯中,再向烧杯中加入少量蒸馏水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
E.改用胶头滴管滴加蒸馏水,使溶液的凹液面恰好与容量瓶的刻度线相切
F.继续往容量瓶中小心地滴加蒸馏水,直到液面接近刻度线1~2cm处
(4)在定容时,液面高于刻度线,则所配溶液的浓度将___(选填“偏高”或“偏低”),该如何处理?___。