题目内容
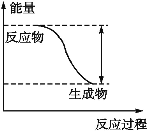
【题目】2SO2(g)+O2(g)2SO3(g)反应过程中的能量变化如图所示。已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH1=-99 kJ/mol。请回答下列问题:

(1)图中A、C分别表示_____、____,E的大小对该反应的反应热有无影响?____(填“有”或“无”)。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?____,理由是_________。
(2)图中ΔH=____kJ/mol。
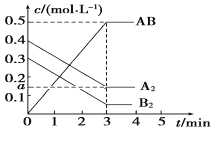
(3)如果反应速率v(SO2)为0.05 mol·L-1·min-1,则v(O2)=____ mol·L-1·min-1,v(SO3)=___mol·L-1·min-1。
【答案】反应物能量 生成物能量 无影响 降低 催化剂改变反应历程,降低活化能E -198 0.025 0.05
【解析】
(1)反应物总能量大于生成物总能量,为放热反应,加入催化剂,活化能减小,反应反应热不变;
(2)根据反应2SO2(g)+O2(g)2SO3(g)结合1mol SO2(g)氧化为1mol SO3的△H=-99kJmol-1计算反应热;
(3)依据化学反应速率之比等于系数之比计算得到。
(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,加入催化剂,活化能减小,反应热不变;该反应通常用V2O5作催化剂,催化剂改变反应速率,降低反应的活化能,改变反应历程,但不改变化学平衡,所以加V2O5会使图中B点降低;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJmol-1,所以2molSO2(g)氧化为2molSO3的△H=-198kJmol-1,则2SO2(g)+O2(g)2SO3(g)△H=-198kJmol-1;
(3)反应的化学方程式为:2SO2(g)+O2(g)2SO3(g),反应速率之比等于系数之比,v(SO2):v(O2):v(SO3)=2:1:2,反应速率υ(SO2)为0.05molL-1min-1,依据比例计算得到v(O2)=0.025mol/Lmin;v(SO3)=0.05molL-1min-1。

 千里马走向假期期末仿真试卷寒假系列答案
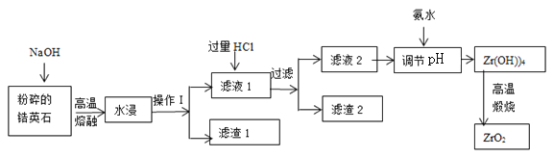
千里马走向假期期末仿真试卷寒假系列答案【题目】氧化锆(ZrO2)材料具有高硬度、高熔点、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有________________________________。
(2)操作I的名称是__________________,滤渣1成分为_________,滤渣2的成分为_____________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:____________________。
(4)“调节pH”时,合适的pH范围是__________________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是__________________。
(5)写出“高温煅烧”过程的化学方程式________________________________。根据ZrO2的性质,推测其一种用途________________________________。